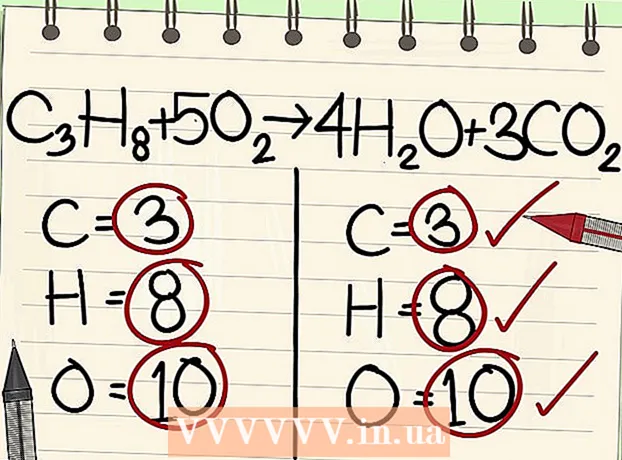
Inhalt
Eng chemesch Equatioun ass eng symbolesch Duerstellung vun enger chemescher Reaktioun. An dësem Fall sinn déi reagéierend Verbindungen (Reagenz) op der lénkser Säit geschriwwen, an déi resultéierend Substanzen (Reaktiounsprodukter) - op der rietser Säit vun der Gleichung. E Pfeil gëtt tëscht hinnen vu lénks op riets gesat, wat d'Richtung vun der Reaktioun uweist. Geméiss dem Gesetz vun der Konservatioun vun der Mass, am Laf vun enger chemescher Reaktioun, kënnen nei Atomer net optrieden oder déi al verschwannen; dofir muss d'Zuel vun den Atomer an de Reaktanten d'selwecht sinn wéi d'Zuel vun den Atomer an de Produkter vun der chemescher Reaktioun . Dësen Artikel beschreift wéi ee chemesch Equatioune mat verschiddene Methoden ausbalancéiert.
Schrëtt
Method 1 vun 2: Traditionell Method
 1 Schreift eng chemesch Equatioun op. Als Beispill, betruecht déi folgend Reaktioun:
1 Schreift eng chemesch Equatioun op. Als Beispill, betruecht déi folgend Reaktioun: - C3H.8 + O.2 -> H.2O + CO2
- Dës Reaktioun beschreift d'Verbrennung vu Propan (C3H.8) a Präsenz vum Sauerstoff fir Waasser a Kuelendioxid (Kuelendioxid) ze bilden.
 2 Schreift d'Zuel vun Atomer fir all Element op. Maacht dëst fir béid Säiten vun der Equatioun. Notéiert d'Abonnementer nieft all Element fir d'Gesamtzuel vun Atomer ze bestëmmen. Schreift d'Symbol fir all Element an der Equatioun an notéiert déi entspriechend Unzuel vun Atomer.
2 Schreift d'Zuel vun Atomer fir all Element op. Maacht dëst fir béid Säiten vun der Equatioun. Notéiert d'Abonnementer nieft all Element fir d'Gesamtzuel vun Atomer ze bestëmmen. Schreift d'Symbol fir all Element an der Equatioun an notéiert déi entspriechend Unzuel vun Atomer. - Zum Beispill, op der rietser Säit vun der Gleichung déi berécksiichtegt gëtt, als Resultat vun der Zousatz, kréien mir 3 Sauerstoffatome.
- Op der lénker Säit hu mir 3 Kuelestoffatomer (C3), 8 Waasserstoffatomer (H8) an 2 Sauerstoffatomer (O.2).
- Op der rietser Säit hu mir 1 Kuelestoffatom (C), 2 Waasserstoffatome (H2) an 3 Sauerstoffatomer (O + O.2).
 3 Spuert Wasserstoff a Sauerstoff fir méi spéit, well se en Deel vun e puer Verbindungen op der lénker a rietser Säit sinn. Wasserstoff a Sauerstoff gehéieren zu verschiddene Molekülen, sou datt et am beschten ass se als lescht ze balanséieren.
3 Spuert Wasserstoff a Sauerstoff fir méi spéit, well se en Deel vun e puer Verbindungen op der lénker a rietser Säit sinn. Wasserstoff a Sauerstoff gehéieren zu verschiddene Molekülen, sou datt et am beschten ass se als lescht ze balanséieren. - Ier Dir Waasserstoff a Sauerstoff ausbalancéiert, musst Dir d'Atome erëm erzielen, well zousätzlech Faktore kënne gebraucht ginn fir aner Elementer ze balanséieren.
 4 Start mat dem mannst heefegen Artikel. Wann Dir e puer Elementer balanséiere musst, wielt een deen Deel vun engem Reagensmolekül an enger Molekül vu Reaktiounsprodukter ass. Also, de Kuelestoff muss als éischt ausgeglach sinn.
4 Start mat dem mannst heefegen Artikel. Wann Dir e puer Elementer balanséiere musst, wielt een deen Deel vun engem Reagensmolekül an enger Molekül vu Reaktiounsprodukter ass. Also, de Kuelestoff muss als éischt ausgeglach sinn.  5 Fir d'Gläichgewiicht, füügt e Faktor virun engem eenzege Kuelestoffatom un. Setzt e Faktor virum eenzege Kuelestoff op der rietser Säit vun der Equatioun fir et mat 3 Kuelestoff op der lénker Säit ze balanséieren.
5 Fir d'Gläichgewiicht, füügt e Faktor virun engem eenzege Kuelestoffatom un. Setzt e Faktor virum eenzege Kuelestoff op der rietser Säit vun der Equatioun fir et mat 3 Kuelestoff op der lénker Säit ze balanséieren. - C3H.8 + O.2 -> H.2O + 3 CO2
- E Faktor vun 3 virum Kuelestoff op der rietser Säit vun der Gleichung weist datt et dräi Kuelestoffatome ginn, déi dem dräi Kuelestoffatomer am Propanmolekül op der lénker Säit entspriechen.
- An enger chemescher Equatioun kënnt Dir d'Koeffizienten virun Atomer a Moleküle änneren, awer d'Abonnementer musse onverännert bleiwen.
 6 Balancéiert dann d'Wasserstoffatome. Nodeems Dir d'Zuel vu Kuelestoffatomer op der lénkser a rietser Säit ausgläiche gelooss, bleift Waasserstoff a Sauerstoff onbalancéiert. Déi lénks Säit vun der Equatioun enthält 8 Waasserstoffatome, déiselwecht Zuel sollt op der rietser Säit sinn. Erreechen dëst mat engem Verhältnis.
6 Balancéiert dann d'Wasserstoffatome. Nodeems Dir d'Zuel vu Kuelestoffatomer op der lénkser a rietser Säit ausgläiche gelooss, bleift Waasserstoff a Sauerstoff onbalancéiert. Déi lénks Säit vun der Equatioun enthält 8 Waasserstoffatome, déiselwecht Zuel sollt op der rietser Säit sinn. Erreechen dëst mat engem Verhältnis. - C3H.8 + O.2 -> 4H2O + 3 CO2
- Mir hunn e Faktor vu 4 no riets bäigefüügt, well den Abonnement weist datt mir scho zwee Waasserstoffatome hunn.
- Wann Dir de Faktor 4 mam Abonnement 2 multiplizéiert, kritt Dir 8.
- Als Resultat ginn 10 Sauerstoffatome op der rietser Säit kritt: 3x2 = 6 Atomer an dräi 3CO Molekülle2 a véier méi Atomer a véier Waassermoleküle.
 7 Balancéiert d'Sauerstoffatome. Denkt drun d'Koeffizienten ze faktoréieren déi Dir benotzt hutt fir déi aner Atomer ze balanséieren. Well Dir d'Koeffizienten virun de Molekülen op der rietser Säit vun der Equatioun derbäigesat hutt, huet d'Zuel vun de Sauerstoffatome geännert. Dir hutt elo 4 Sauerstoffatome a Waassermoleküle a 6 Sauerstoffatome a Kuelendioxidmoleküle. Also ginn et 10 Sauerstoffatome op der rietser Säit.
7 Balancéiert d'Sauerstoffatome. Denkt drun d'Koeffizienten ze faktoréieren déi Dir benotzt hutt fir déi aner Atomer ze balanséieren. Well Dir d'Koeffizienten virun de Molekülen op der rietser Säit vun der Equatioun derbäigesat hutt, huet d'Zuel vun de Sauerstoffatome geännert. Dir hutt elo 4 Sauerstoffatome a Waassermoleküle a 6 Sauerstoffatome a Kuelendioxidmoleküle. Also ginn et 10 Sauerstoffatome op der rietser Säit. - Füügt e Faktor vu 5 un de Sauerstoffmolekül op der lénker Säit vun der Gleichung. All Stéck enthält elo 10 Sauerstoffatome.
- C3H.8 + 5O2 -> 4H2O + 3 CO2.

- Also, béid Säiten vun der Equatioun enthalen déiselwecht Unzuel u Kuelestoff, Waasserstoff, a Sauerstoffatome. D'Gläichung ass ausgeglach.
Method 2 vun 2: Algebraesch Method
- 1 Schreift d'Reaktiounsgläichung op. Als Beispill, betruecht déi folgend chemesch Reaktioun:
- PCl5 + H.2O -> H.3PO4 + HCl
- 2 Setzt e Bréif virun all Verbindung:
- aPCl5 + bH.2O -> An cH.3PO4 + dHCl
- 3 Gläicht d'Zuel vun Atomer fir all Element op der lénkser a rietser Säit vun der Equatioun.
- aPCl5 + bH.2O -> An cH.3PO4 + dHCl
- Lénks hu mir 2b Waasserstoffatome (2 an all H2O), wärend op der rietser 3c+d Waasserstoffatome (3 an all H3PO4 an 1 an all HCl Molekül). Well déi lénks a riets Säit déiselwecht Unzuel vu Waasserstoffatome mussen enthalen, 2b soll gläich wéi 3 sinnc+d.
- Maacht dëst fir all Elementer:
- P: a=c
- Cl: 5a=d
- H: 2 anb=3c+d
- 4 Solvéiert de System vun de Gleichungen fir déi numeresch Wäerter vun de Koeffizienten ze fannen. De System huet verschidde Léisungen, well et gi méi Variabelen wéi Equatioune. Et ass noutwendeg fir sou eng Léisung ze fannen sou datt all Koeffizienten d'Form vun de klengste méiglechen ganz Zuelen hunn.
- Fir séier e System vun Equatioune ze léisen, gitt en numeresche Wäert un eng vun de Variabelen zou. Ugeholl a = 1. Loosst eis de System léisen an d'Wäerter vun de verbleibende Variabelen fannen:
- Fir P a = c, also c = 1
- Fir Cl 5a = d, dofir d = 5
- Well fir H 2b = 3c + d, fanne mir de Wäert b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4 dir
- Also hu mir déi folgend Koeffizienten:
- a = 1 an
- b = 4 dir
- c = 1 dir
- d = 5
Tipps
- Wann Dir Schwieregkeeten hutt, kann en Online Rechner benotzt gi fir chemesch Gläichungen ze balanséieren. W.e.g. bemierkt awer datt sou e Rechner net erlaabt ass während dem Examen ze benotzen, also vertraut net nëmmen drop.
- Denkt drun, heiansdo kann d'Gleichung vereinfacht ginn! Wann all Koeffizienten souguer mat engem ganzt geteilt sinn, vereinfacht d'Gleichung.
Warnungen
- Fir vu Fraktiounskoeffizienten lass ze ginn, multiplizéiert déi ganz Equatioun (seng lénks a riets Säit) mam Nenner vun der Fraktioun.
- Benotzt ni Fraktiounen als Koeffizienten vun der chemescher Equatioun - et gi keng hallef Moleküle oder Atomer a chemesche Reaktiounen.
- Am Balancéierungsprozess kënnt Dir Fraktiounen fir d'Bequemlechkeet benotzen, awer d'Gleichung ass net ausgeglach soulaang et Fraktiounskoeffizienten dran sinn.