Auteur:
Randy Alexander
Denlaod Vun Der Kreatioun:
1 Abrëll 2021
Update Datum:
1 Juli 2024
Inhalt
An der Chimie, valence Elektronen sinn Elektronen an der baussechster Schicht vun der Elektroneschuel vun engem Element. D'Bestëmmung vun der Unzuel vun de Valenzelektronen vun engem Element ass eng wichteg Technik an der Chimie, well dës Informatioun hëlleft d'Typen vun Obligatiounen ze bestëmmen, déi Element ka bilden. D'Bestëmmung vun der Unzuel vu valence Elektronen kann einfach mat der periodescher Tabelle vu chemeschen Elementer gemaach ginn.
Schrëtt
Deel 1 vun 2: Fannt d'Zuel vu valence Elektronen mat der periodescher Tabelle
Mat net-Iwwergangsmetall
Hunn eng prett periodesch Dësch chemesch Elementer. Déi periodesch Tabelle vun Elementer (kuerz d'Periodesch Tabelle) ass eng Faarfkodéiert Multi-Zell-Tabelle déi all déi bekannten Elementer wéi och e puer wesentlech Informatiounen iwwer déi Elementer. Baséierend op déi verfügbar Informatioun an der periodescher Tabelle kënne mir d'Zuel vu valence Elektronen vum Element bestëmmen, dat mir ënnersichen. Déi periodesch Tabelle gëtt normalerweis un e Léierbuch befestegt. Dir kënnt och op dës existent interaktiv Periodesch Tabelle referéieren.

Nummeréiert all Kolonn an der periodescher Tabell vun 1 bis 18. Normalerweis an der periodescher Tabell hunn all Elementer an der selwechter Kolonn déiselwecht Zuel vu valence Elektronen. Wann Är periodesch Tabelle nach net Säulen nummeréiert hunn, maacht et selwer andeems Dir 1 bis 18 vertikal vu lénks no riets nummeréiert. Wëssenschaftlech gëtt all Kolonn an der periodescher Tabell eng genannt "Grupp".- Zum Beispill, fir eng net ënnerschriwwe Periodesch Tabelle wäerte mir 1 iwwer Waasserstoff (H), 2 iwwer Beri (Be) nummeréieren an datselwecht maachen bis 18 iwwer Helium (He ).

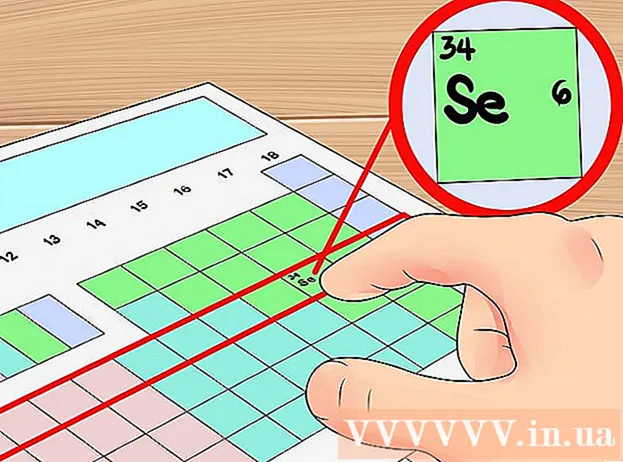
Bestëmmt d'Positioun vum betreffenden Element. An dësem Schrëtt bestëmmt d'Positioun vum Element, deen Dir am Periode kuckt. Dir fannt d'Positioun vun engem Element baséiert op sengem chemesche Symbol (Buschtaf an all Zell), Atomnummer (d'Nummer an der ieweschter lénkser Eck vun all Zell), oder baséiert op Informatioun Messagen sinn um periodeschen Dësch verfügbar.- Zum Beispill musse mir d'Zuel vu valence Elektronen vum Element fannen Kuelestoff (C). D'Atomzuel vum Element ass 6. De Kuelestoff ass am ieweschten Deel vun der Grupp 14. Elementer.An de nächste Schrëtt wäerte mir d'Zuel vu Valenceelektronen vun dësem Element bestëmmen.
- An dëser Sektioun ignoréiere mir Transitiounsmetaller, dh Elementer am Beräich vun de Gruppen 3 bis 12. Dës Iwwergangsmetaller si liicht anescht wéi de Rescht, sou datt d'Schrëtt sinn D'Instruktioune ginn an dëser Sektioun gëllen net fir sou Metaller. Mir kucken dës Gruppen vun Elementer méi spéit am Artikel.

Benotzt d'Gruppenummer fir d'Zuel vu valence Elektronen ze bestëmmen. D'Gruppennummer vun engem net-Iwwergangsmetall kann benotzt ginn fir d'Zuel vu Valence-Elektronen am Atom vun deem Element ze berechnen. D '"Eenheetsrei vun der Gruppennummer" ass d'Zuel vu valence Elektronen, déi an den Atomer vun den Elementer vun där Grupp präsent sinn. An anere Wierder:- Grupp 1: 1 Valence Elektron
- Grupp 2: 2 Valence Elektronen
- Grupp 13: 3 Valence Elektronen
- Grupp 14: 4 Valence Elektronen
- Grupp 15: 5 Valence Elektronen
- Grupp 16: 6 Valence Elektronen
- Grupp 17: 7 Valence Elektronen
- Grupp 18: 8 Valence Elektronen (ausser Helium mat 2 Valence Elektronen)
- Am Kuelestoff Beispill, well de Kuelestoff an der Grupp 14 ass, kënne mir soen datt e Kuelestoff huet véier Valence Elektronen.
Mat Iwwergangsmetall
Identifizéiert en Element am Beräich vu Grupp 3 bis Grupp 12. Wéi uewen ernimmt, ginn d'Elementer an de Gruppen 3 bis 12 "Iwwergangsmetaller" genannt a wat Valenselektronen ugeet hunn dës aner Eegeschafte vum Rescht. An dëser Sektioun léiere mir firwat et dacks net méiglech ass, Valenselektronen un d'Atomer vun Iwwergangsmetaller ze weisen.
- An dëser Sektioun huele mir d'Element Tantan (Ta) deem seng Atomzuel 73 als Beispill ass. Déi nächst Schrëtt hëllefen d'Element Zuel vu Valence Elektronen ze bestëmmen.
- Bedenkt datt d'Elementer vun den dräi Familljelantanen an Actinium (och bekannt als "seelen Äerdmetaller") gehéieren och zu der Grupp vun Iwwergangsmetaller - dës zwou Gruppen vun Elementer ginn normalerweis ënner dem Perioden opgezielt. Kapp mam Lantan an Actini.
Valence Elektronen an Iwwergangsmetaller sinn net déiselwecht wéi 'normal' Valence Elektronen '. Fir ze verstoen firwat Iwwergangsmetaller net wierklech "funktionnéieren" wéi aner Elementer um periodeschen Dësch, musse mir e bëssen wëssen wéi Elektronen am Atom funktionnéieren, wéi et hei ënnendrënner erkläert gëtt. , oder Dir kënnt dëse Schrëtt iwwersprangen.
- Wann Elektronen an en Atom agefouert ginn, gi se a verschidden "Orbitalen" arrangéiert - verschidde Regioune ronderëm de Kär. Kuerz, Valence-Elektronen sinn d'Elektronen am baussenzegen Ëmlaf - an anere Wierder, déi lescht Elektronen déi zum Atom bäigefüügt goufen.
- D'Bunn am Detail z'erklären ass vläicht e bësse komplizéiert, wann Elektronen zu der Ënnerklass bäigefüügt ginn d vun der Atomschuel vum Iwwergangsmetall (kuckt ënnen), wäert déi éischt vun dësen Elektronen sech wéi normal Valenzelektronen verhalen, awer da kënnen hir Eegeschafte sech änneren, duebel wann Elektronen aus aneren Orbitalen als Valence-Elektronen handele kënnen. Dat heescht, en Atom kann jee no Fall méi valent Elektronen hunn.
- Dir kënnt méi iwwer dëst léieren op der Clackamas Community College valence Elektron Site.
Bestëmmt d'Zuel vu valence Elektronen op Basis vun der Gruppennummer. Wéi uewe fir Net-Iwwergangsmetaller bemierkt, kann d'Gruppennummer um periodeschen Dësch hëllefen d'Zuel vu Valence-Elektronen ze bestëmmen. Wéi och ëmmer, et gëtt keng definitiv Formel fir d'exakt Zuel vu Valence-Elektronen vum Iwwergangsmetall ze bestëmmen - an dësem Fall ass d'Zuel vu Valence-Elektronen vun engem Element net zu engem feste Wäert, d'Zuel vun de Saachen. Selwergruppe kënnen nëmmen eng relativ Unzuel vu Valence-Elektronen soen. Detail:
- Grupp 3: 3 Valence Elektronen
- Gruppen vu 4: 2 bis 4 Valenzelektronen
- Grupp 5: 2 bis 5 Valence Elektronen
- Grupp 6: 2 bis 6 Valence Elektronen
- Gruppen 7: 2 bis 7 Valenzelektronen
- Gruppen vun 8: 2 bis 3 Valenzelektronen
- Gruppen 9: 2 bis 3 Valenzelektronen
- Gruppen vun 10: 2 bis 3 Valenzelektronen
- Gruppen 11: 1 bis 2 Valenzelektronen
- Grupp 12: 2 Valence Elektronen
- Huele mer d'Beispill vum Element Tanta (Ta) aus der Grupp 5, kënne mir soen datt dëst Element huet vun 2 bis 5 Valence Elektronen, ofhängeg vum Fall.
Deel 2 vun 2: Fannt d'Zuel vu valence Elektronen baséiert op Elektronekonfiguratioun
Léiert wéi Dir Elektronekonfiguratioun liest. Baséierend op der Elektronekonfiguratioun vun engem Element kënne mir och d'Zuel vu Valenzelektronen vun deem Element bestëmmen. Elektronekonfiguratioun gesäit komplizéiert aus, awer et ass just wéi d'Orbitalen vun engem Element a Form vu Buschtawen an Zuelen ze representéieren, wann Dir d'Gesetz erfaasst hutt, d'Elektronekonfiguratioun ze verstoen ass net schwéier.
- Betruecht e Beispill Elektronekonfiguratioun vun Natrium (Na):
- 1s2s2p3s
- Wann Dir oppasst, da gesitt Dir datt d'Elektronekonfiguratioun just e String vu Widderhuelungen ass:
- (Nummer) (Wuert) (Nummer) (Wuert) ...
- ... a sou weider. Grupp (Nummer) (Wuert) dat éischt ass den Numm vun der Bunn a bezeechent d'Zuel vun den Elektronen an deem Bunn.
- Also, an eisem Fall kënne mir soen datt Natrium et mécht 2 Elektronen an der 1s Bunn, 2 Elektronen an den 2er Bunn, 6 Elektronen an engem 2p Orbit an 1 Elektron an 3 3s Bunn. Et ginn 11 Elektronen am Ganzen - d'Natrium Atomzuel ass och 11.
- Betruecht e Beispill Elektronekonfiguratioun vun Natrium (Na):
Fannt d'Elektronekonfiguratioun vum Element wat Dir sicht. Wann Dir d'Elektronekonfiguratioun vun engem Element wësst, ass d'Elektronekonfiguratioun vun deem Element ze fannen net schwéier (ausser am Fall vun Iwwergangsmetaller). Wann d'Elektronekonfiguratioun verfügbar ass an der Fro déi Dir braucht ze léisen, kënnt Dir dëse Schrëtt iwwersprangen. Wann Dir d'Elektronekonfiguratioun fanne musst, fuert weider mat dëse Schrëtt:
- Déi komplett Elektronekonfiguratioun vum Element ununocti (Uuo), der Atomzuel 118 ass:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Wann Dir sou eng komplett Elektronekonfiguratioun hutt, fir d'Elektronekonfiguratioun vun engem aneren Element ze fannen, musst Dir just d'Orbitaler mat Elektronen ausfëllen, ugefaange mat der éischter Ëmlafbunn, bis d'Zuel vun den Elektronen ausgefëllt ass. Et kléngt komplizéiert, awer wann et drëm geet et ze maachen ass et relativ einfach. Zum Beispill, wa mir déi komplett Elektronekonfiguratioun vu Chlor (Cl), Element 17 schreiwen, dat heescht, dëst Atom vun dësem Element huet 17 Elektronen, wäerte mir folgend ausfëllen:
- 1s2s2p3s3p
- Bedenkt datt d'Gesamtzuel vun Elektronen an der Elektronekonfiguratioun just richteg ass 17: 2 + 2 + 6 + 2 + 5 = 17. Dir musst just d'Zuel op der leschter Ëmlafbunn änneren - de Rescht bleift déiselwecht, well de bal virleefegen Orbit ass voll. Elektron.
- Léiert méi iwwer wéi een Element Elektronekonfiguratioun schreift.
- Déi komplett Elektronekonfiguratioun vum Element ununocti (Uuo), der Atomzuel 118 ass:

Assignéiert Elektronen un Orbitalen no der Aachte Regel. Wann Elektronen zu engem Atom bäigefüügt ginn, ginn se an Orbitalen an der Uerdnung uginn sortéiert - déi éischt zwee Elektronen ginn an der 1s Bunn plazéiert, déi nächst zwou Elektronen an der 2s Bunn, déi nächst sechs Elektronen sinn an der Bunn plazéiert 2p, maach dat bis den Elektron an den entspriechenden Orbit plazéiert ass. Wa mir d'Atomer vun net-Iwwergangselementer berécksiichtegen, kënne mir soen datt dës Orbitaler "Schichten" ronderëm de Kär bilden, an där déi folgend Schicht méi wäit vum Kär ewech ass wéi dee virdrun. Nieft der éischter Bunnschicht déi nëmme bis zu zwee Elektronen hale kann, kënnen all uschléissend Bunnschichte bis zu aacht Elektronen halen (ausser am Fall vun Iwwergangsmetaller). Dës Regel gëtt genannt Déi aachtfacht Regel.- Betruecht zum Beispill d'Element Bo (B). D'Atomzuel vun dësem Element ass 5, also hu mir d'Elektronekonfiguratioun vun dësem Element wéi folgend: 1s2s2p. Well déi éischt Bunnschuel nëmmen 2 Elektronen enthält, ass et méiglech ze bestëmmen datt Bo zwou Bunnschichten huet: déi éischt besteet aus 2 Elektronen op der 1s Bunn an der zweeter mat dräi Elektronen verdeelt an den 2s an 2p Orbitalen. .
- Fir en anert Beispill hätt en ähnlecht Element wéi Chlor 3 Schichten: eng Schicht vun zwee Elektronen an der 1s Bunn, enger Schicht vun zwee Elektronen an der 2s Bunn a sechs Elektronen an der 2p Bunn, an enger bausseger Schicht vun zwee Elektronen an der 3 Bunn. a fënnef Elektronen an engem 3p Orbit.

Fannt d'Zuel vun Elektronen an der baussechster Schicht. Wann d'Elektronekonfiguratioun festgeluecht gouf, wësse mer scho d'Schichten vun deem Element, d'Zuel vun de Valenzelektronen ze fannen kann duerch Bestëmmung vun der Unzuel vun Elektronen an der bausseger Schicht vun der atomarer Elektroneschuel gemaach ginn. Wann déi baussesch Schicht voll ass (dh scho mat insgesamt aacht Elektronen, oder fir déi éischt Schicht 2 Elektronen) da gëtt dat Element en inert Element genannt a gëtt kaum a chemesche Reaktiounen involvéiert. Wéi och ëmmer, dës Regel gëllt net fir Iwwergangsmetaller.- Zum Beispill Bo, well Bo dräi Elektronen an der zweeter Schicht huet, och déi baussenzeg Schicht, also kënne mir soen datt Element Bo Papp valence Elektronen.

Benotzt d'Reiennummer op dem periodeschen Dësch als ofgekierzt Wee fir d'Zuel vun den Ëmlafschichten ze bestëmmen. Déi horizontal Zeil um periodesche System gëtt genannt "Zyklus" vun den Elementer. Vun der éischter Zeil un entsprécht all Zyklus der "Zuel vun Elektroneschichten" vun den Elementer an der selwechter Period. Dofir kënnt Dir d'Period benotze fir séier d'Zuel vu valence Elektronen vun engem Element ze bestëmmen - Dir zielt just d'Zuel vun den Elektronen an Uerdnung vu lénks no riets vum éischte Element vun där Period. Notéiert nach eng Kéier datt dëst net fir Iwwergangsmetaller applicabel ass.- Zum Beispill, well Selen zum Zyklus 4 gehéiert, kann et festgestallt ginn datt d'Element véier Elektroneschichten an der Atomschuel huet. Well vu lénks op riets dat ass dat sechste Element am Zyklus 4 (ausser den Iwwergangsmetall), kënne mir soen datt déi véiert Schuel vu Selen sechs Elektronen huet, d.h. sechs Valence Elektronen.
Berodung
- Opgepasst, d'Elektronekonfiguratioun kann kuerz mat seltenen Gasen (Elementer aus der Grupp 18) amplaz vun Orbitalen uewen an der Konfiguratioun geschriwwe ginn. Zum Beispill kann d'Elektronekonfiguratioun vum Natrium als 3s1 geschriwwe ginn - dat heescht d'Elektronekonfiguratioun vun Natrium ass déiselwecht wéi déi vum Neon awer et gëtt en extra Elektron am 3s Orbit.
- Iwwergangsmetaller kënnen onvollstänneg Valenzunterclassen hunn. Fir d'Walenszuel vum Iwwergangsmetall präzis ze bestëmmen, ass et néideg komplex Quanteprinzipien anzesetzen déi net vun dësem Artikel ofgedeckt sinn.
- Et ass och wichteg ze bemierken datt d'Periodesch Tabelle vu chemeschen Elementer a verschiddene Länner anescht ka sinn. Also, gitt sécher datt Dir de gemeinsame periodesche System benotzt wou Dir wunnt fir Duercherneen ze vermeiden.
Wat Dir braucht
- Periodesch Tabelle vu chemeschen Elementer
- Bläistëft
- Pabeier