Auteur:
Florence Bailey
Denlaod Vun Der Kreatioun:
21 Mäerz 2021
Update Datum:
1 Juli 2024
Inhalt
- Schrëtt
- Method 1 vun 2: Verdeelung vun Elektronen mam periodesche System vum D. I. Mendeleev
- Method 2 vun 2: Benotzt d'ADOMAH Periodic Table
- Tipps
Elektronesch Konfiguratioun en Atom ass eng numeresch Duerstellung vu sengen Elektronenorbitaler. Elektronesch Orbitaler si Regioune vu verschiddene Formen, déi ronderëm en Atomkär sinn, an deem en Elektron mathematesch wahrscheinlech ass. Elektronesch Konfiguratioun hëlleft dem Lieser séier an einfach ze soen wéivill Elektronorbitaler en Atom huet, souwéi d'Zuel vun den Elektronen an all Ëmlafbunn ze bestëmmen. Nodeems Dir dësen Artikel gelies hutt, hutt Dir d'Method beherrscht fir elektronesch Konfiguratiounen ze generéieren.
Schrëtt
Method 1 vun 2: Verdeelung vun Elektronen mam periodesche System vum D. I. Mendeleev
 1 Fannt d'Atomenummer vun Ärem Atom. All Atom huet eng spezifesch Unzuel vun Elektronen domat verbonnen. Fannt d'Symbol fir Ären Atom an der periodescher Tabelle. Eng Atomzuel ass e positiven Ganztall, dee mat 1 ufänkt (fir Waasserstoff) an eropgeet mat engem fir all spéider Atom. Eng Atomzuel ass d'Zuel vu Protonen an engem Atom, an dofir ass et och d'Zuel vun den Elektronen an engem Atom mat Null Ladung.
1 Fannt d'Atomenummer vun Ärem Atom. All Atom huet eng spezifesch Unzuel vun Elektronen domat verbonnen. Fannt d'Symbol fir Ären Atom an der periodescher Tabelle. Eng Atomzuel ass e positiven Ganztall, dee mat 1 ufänkt (fir Waasserstoff) an eropgeet mat engem fir all spéider Atom. Eng Atomzuel ass d'Zuel vu Protonen an engem Atom, an dofir ass et och d'Zuel vun den Elektronen an engem Atom mat Null Ladung. - 2 Bestëmmt d'Ladung vun engem Atom. Neutral Atomer wäerten déiselwecht Unzuel vun Elektronen hunn wéi an der Periodescher Tabelle gewise gëtt. Wéi och ëmmer, gelueden Atomer wäerten méi oder manner Elektronen hunn, ofhängeg vum Betrag vun hirer Ladung. Wann Dir mat engem geluedenen Atom schafft, füügt oder subtrahéiert Elektronen wéi follegt: füügt een Elektron fir all negativ Ladung a subtrahéiert een fir all positiv.
- Zum Beispill huet en Natriumatom mat enger Ladung vun -1 en extra Elektron zousätzlech op seng Basis Atomzuel 11. An anere Wierder, de Gesamtatom wäert 12 Elektronen hunn.
- Wa mir iwwer e Natriumatom mat enger Ladung vun +1 schwätzen, muss een Elektron vun der Basisatom Nummer 11 ofgezunn ginn. Also wäert den Atom 10 Elektronen hunn.
- 3 Denkt un d'Basislëscht vun den Orbitaler. Wéi d'Zuel vun den Elektronen eropgeet, fëllen se déi verschidde Subniveauen vun der Elektroneschuel vum Atom no enger gewësser Sequenz. All Ënnergrond vun der Elektroneschuel, wann gefëllt, enthält eng gläich Zuel vun Elektronen. Déi folgend Niveaue si verfügbar:
- s-Niveau (all Nummer an der elektronescher Konfiguratioun déi virum Bréif "s" kënnt) enthält eng eenzeg Ëmlafbunn, an, laut Dem Pauli säi Prinzip, eng Ëmlafbunn ka maximal 2 Elektronen enthalen, dofir kënnen et 2 Elektronen op all s-Ënnergrond vun der Elektroneschuel sinn.
- p-Niveau enthält 3 Orbitaler, an dowéinst kënne maximal 6 Elektronen enthalen.
- d-Niveau enthält 5 Orbitaler, sou datt et bis zu 10 Elektronen hunn.
- f-Niveau enthält 7 Orbitaler, sou datt et bis zu 14 Elektronen hunn.
- g-, h-, i- a k-Subniveauen sinn theoretesch. D'Atome mat Elektronen an dësen Orbitaler sinn onbekannt. D'G-Sublevel enthält 9 Orbitaler, sou datt theoretesch et 18 Elektronen hätt. Den h-Sublevel kann 11 Orbitaler hunn a maximal 22 Elektronen; an den i -Sublevel -13 Orbitaler a maximal 26 Elektronen; am k -Sublevel - 15 Orbitaler a maximal 30 Elektronen.
- Memoréiert d'Uerdnung vun den Orbitaler mam mnemoneschen Trick:
S.ober P.Hysiker D.op net F.ind G.iraffes H.idéieren Echn KJucken (sober Physiker fannen keng Giraffen, déi sech an de Kichen verstoppen).
- 4 Verstinn den elektronesche Konfiguratiounsrekord. Elektronesch Konfiguratiounen ginn opgeholl fir d'Zuel vun den Elektronen an all Ëmlafbunn kloer ze reflektéieren. Orbitaler ginn sequenziell geschriwwen, mat der Unzuel vun Atomer an all Ëmlafbunn superscript riets vum Orbitalnumm. Déi fäerdeg elektronesch Konfiguratioun hëlt d'Form vun enger Sequenz vu Sublevelbezeechnungen a SuperScripts.
- Zum Beispill déi einfachst elektronesch Konfiguratioun: 1s 2s 2p. Dës Konfiguratioun weist datt et zwee Elektronen um 1s Ënnerleef sinn, zwee Elektronen um 2s Ënnergrond, a sechs Elektronen um 2p Ënneniveau. 2 + 2 + 6 = 10 Elektronen am Ganzen. Dëst ass d'elektronesch Konfiguratioun vun engem neutrale Neonatom (Neon Atomnummer ass 10).
- 5 Denkt un d'Uerdnung vun den Orbitaler. Denkt drun datt d'Elektronorbitaler an opsteigend Uerdnung vun der Elektroneschuelnummer nummeréiert sinn, awer an opsteigend Uerdnung vun der Energie. Zum Beispill ass eng gefëllt 4s Ëmlafbunn manner energesch (oder manner mobil) wéi en deelweis gefüllten oder gefëllten 3d, sou datt d'4s Ëmlafbunn als éischt opgeholl gëtt. Wann Dir d'Uerdnung vun den Orbitaler kennt, kënnt Dir se einfach no der Unzuel vun Elektronen am Atom ausfëllen. D'Uerdnung fir d'Orbitaler ze fëllen ass wéi follegt: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Déi elektronesch Konfiguratioun vun engem Atom an deem all Orbitaler gefëllt sinn wäert déi folgend Form hunn: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Notéiert datt déi uewe genannte Entrée, wann all Orbitaler gefëllt sinn, d'elektronesch Konfiguratioun vum Element Uuo (ununoctium) 118 ass, dat héchst nummeréiert Atom am Periodesystem. Dofir enthält dës elektronesch Konfiguratioun all aktuell bekannt elektronesch Ënnergrënn vun engem neutral geluedenen Atom.
- 6 Fëllt d'Orbitaler no der Unzuel vun Elektronen an Ärem Atom aus. Zum Beispill, wa mir d'elektronesch Konfiguratioun vun engem neutrale Kalziumatom wëllen opschreiwen, musse mir ufänken no senger Atommummer am periodeschen Dësch ze sichen. Seng Atommass ass 20, sou datt mir d'Konfiguratioun vun engem Atom mat 20 Elektronen no der uewe Uerdnung schreiwen.
- Fëllt d'Orbitaler an der Uerdnung uewe bis Dir den zwanzegsten Elektron erreecht. Déi éischt 1s Ëmlafbunn enthält zwee Elektronen, d'2s Orbitaler wäerten och zwee hunn, 2p - sechs, 3s - zwee, 3p - 6, a 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) An anere Wierder, d'elektronesch Konfiguratioun vu Kalzium ass: 1s 2s 2p 3s 3p 4s.
- Notéiert datt d'Orbitaler an opsteigend Uerdnung vun der Energie sinn. Zum Beispill, wann Dir prett sidd fir op de 4. Energieniveau ze goen, da schreift als éischt d'4s Bunn, an dann 3 d. Nom véierten Energieniveau gitt Dir op de fënneften, wou déi selwecht Uerdnung widderholl gëtt. Dëst geschitt nëmmen nom drëtten Energieniveau.
- 7 Benotzt de periodesche Dësch als visuell Hiweis. Dir hutt wahrscheinlech scho gemierkt datt d'Form vum periodesche Dësch der Uerdnung vun elektroneschen Ënnergrënn an elektronesche Konfiguratiounen entsprécht. Zum Beispill, d'Atomer an der zweeter Kolonn vu lénks lafen ëmmer op "s", wärend d'Atomer um richtege Rand vum dënnen mëttleren Sektioun ëmmer op "d" ophalen, a sou weider. Benotzt de periodesche Dësch als visuellen Guide fir d'Konfiguratiounen ze schreiwen - wéi d'Uerdnung an där Dir Orbitaler derbäi kënnt entsprécht Ärer Positioun an der Tabell. Kuckt ënnen:
- Besonnesch déi zwou lénksste Säulen enthalen Atomer deenen hir elektronesch Konfiguratiounen op s-Orbitaler ophalen, de richtege Block vum Dësch enthält Atomer deenen hir Konfiguratiounen op p-Orbitaler ophalen, an am ënneschten Deel, Atomer f-Orbitalen.
- Zum Beispill, wann Dir d'elektronesch Konfiguratioun vu Chlor opschreift, denkt esou: "Dëst Atom läit an der drëtter Reih (oder" Period ") vum Periodesystem. Et ass och an der fënnefter Grupp vum p Ëmlafblock vum periodesche System. Dofir wäert hir elektronesch Konfiguratioun op .3p
- Notéiert w.e.g.: d'Elementer an der Regioun vun den d an f Orbitaler vum Dësch si charakteriséiert duerch Energieniveauen déi net der Period entspriechen an där se sinn. Zum Beispill, déi éischt Zeil vum Block vun Elementer mat d-Orbitaler entsprécht 3d Orbitaler, och wann se an der 4. Period läit, an déi éischt Zeil vun Elementer mat f-Orbitaler entsprécht der 4f Bunn, trotz der Tatsaach datt et ass an der 6. Period.
- 8 Léiert d'Shorthand fir laang elektronesch Konfiguratiounen ze schreiwen. D'Atomer um richtege Rand vum Periodesystem ginn genannt Edelgase. Dës Elementer si chemesch ganz stabil. Fir de Prozess ze schreiwen fir laang elektronesch Konfiguratiounen ze schreiwen, schreift einfach a Quadratklammeren de chemesche Symbol vum nootsten Edelgas mat manner Elektronen wéi Ären Atom, a schreift dann weider d'elektronesch Konfiguratioun vun de spéideren Ëmlafniveauen. Kuckt ënnen:
- Fir dëst Konzept ze verstoen ass et hëllefräich eng Beispill Konfiguratioun ze schreiwen. Loosst eis d'Konfiguratioun fir Zénk (Atomnummer 30) mat der Adelgas Ofkierzung schreiwen. Déi komplett Zinkkonfiguratioun gesäit esou aus: 1s 2s 2p 3s 3p 4s 3d. Wéi och ëmmer, mir gesinn datt 1s 2s 2p 3s 3p d'elektronesch Konfiguratioun vum Argon ass, en Edelgas. Einfach den elektronesche Konfiguratiounsdeel vum Zink ersetzen mat dem chemesche Symbol Argon a Quadratklammern ([Ar].)
- Also, déi elektronesch Konfiguratioun vum Zink, geschriwwen an enger verkierzter Form, ass: [Ar] 4s 3 d.
- Notéiert datt wann Dir d'elektronesch Konfiguratioun vun engem Edelgas schreift, sot den Argon, Dir kënnt net [Ar] schreiwen! Ee muss d'Reduktioun vum Adelgas vis -à -vis vun dësem Element benotzen; fir Argon wäert et Neon ([Ne]) sinn.
Method 2 vun 2: Benotzt d'ADOMAH Periodic Table
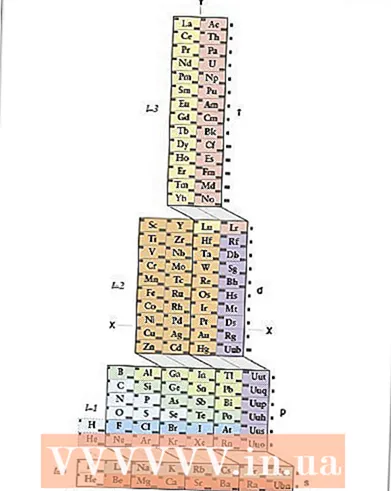
 1 Léiert d'ADOMAH periodesch Tabelle. Dës Method fir d'elektronesch Konfiguratioun opzehuelen erfuerdert keng Erënnerung, awer se erfuerdert eng iwwerschafft periodesch Tabell, well an der traditioneller periodescher Tabelle, ugefaang vun der véierter Period, entsprécht d'Periodnummer net der Elektroneschuel. Fannt d'ADOMAH Periodic Table - eng speziell Zort periodesch Tabelle entwéckelt vum Wëssenschaftler Valery Zimmerman. Et ass einfach et mat enger kuerzer Sich um Internet ze fannen.
1 Léiert d'ADOMAH periodesch Tabelle. Dës Method fir d'elektronesch Konfiguratioun opzehuelen erfuerdert keng Erënnerung, awer se erfuerdert eng iwwerschafft periodesch Tabell, well an der traditioneller periodescher Tabelle, ugefaang vun der véierter Period, entsprécht d'Periodnummer net der Elektroneschuel. Fannt d'ADOMAH Periodic Table - eng speziell Zort periodesch Tabelle entwéckelt vum Wëssenschaftler Valery Zimmerman. Et ass einfach et mat enger kuerzer Sich um Internet ze fannen. - Am periodesche Dësch vun ADOMAH representéieren horizontale Reien Gruppe vun Elementer wéi Halogenen, Edelgase, Alkalimetaller, Äerdalkalimetaller, asw. Vertikal Säulen entspriechen den elektroneschen Niveauen, a sougenannt "Kaskaden" (diagonal Linnen, déi d'Blocke s, p, d a f verbannen) entspriechen Perioden.
- Helium gëtt op Waasserstoff geréckelt well béid vun dësen Elementer en 1s Ëmlafbunn hunn. Periodeblöcke (s, p, d a f) ginn op der rietser Säit gewisen, an Niveauzuelen ginn ënnen ugewisen. D'Elementer ginn a Këschte gewisen, déi 1 bis 120 nummeréiert sinn. Dës Zuelen si üblech Atomzuelen, déi d'Gesamtzuel vun den Elektronen an engem neutrale Atom duerstellen.
- 2 Fannt Ären Atom an der ADOMAH Tabelle. Fir d'elektronesch Konfiguratioun vun engem Element opzehuelen, fënnt säi Symbol an der ADOMAH periodeschen Dësch a kräizt all Elementer mat enger méi héijer Atommummer aus. Zum Beispill, wann Dir d'elektronesch Konfiguratioun vum Erbium (68) musst opschreiwen, sträicht all Elementer vun 69 op 120.
- Notéiert d'Zuelen 1 bis 8 um Enn vum Dësch. Dëst sinn elektronesch Niveau Zuelen, oder Kolonnnummeren. Ignoréiert Kolonnen déi nëmmen duerchgestrachenem Elementer enthalen.Fir Erbium bleiwen d'Kolonnen nummeréiert 1, 2, 3, 4, 5 a 6.
- 3 Zielt d'Ëmlafbunn Ënnergrënn fir Äert Element. Wann Dir d'Spärsymboler uewe riets vun den Tabelle (s, p, d, a f) an d'Kolonnennummeren ënnen ugewise kuckt, ignoréiert déi diagonal Linnen tëscht de Blocken a briechen d'Kolonnen a Kolonnblocken an Uerdnung vun ënnen uewen. Ignoréiert d'Këschte mat all de gekräizte Elementer. Schreift d'Kolumnblocken un, unzefänken mat der Kolonnnummer gefollegt vum Block Symbol, also: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (fir Erbium).
- Bemierkung: Déi uewe genannte elektronesch Konfiguratioun Er gëtt an opsteigender Uerdnung vun der elektronescher Ënnersichennummer geschriwwen. Et kann och an der Uerdnung geschriwwe ginn fir d'Orbitaler ze fëllen. Fir dëst ze maachen, befollegt d'Kaskaden vun ënnen no uewen, net d'Kolonnen wann Dir d'Kolonnblocken schreift: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Zielt d'Elektronen fir all elektronescht Ënnergrond. Zielt d'Elementer an all Blockkolonn déi net duerchgestraalt sinn, befestegt een Elektron vun all Element, a schreift hir Nummer nieft dem Block Symbol fir all Block Kolonn wéi follegt: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s vun ... An eisem Beispill ass dëst d'elektronesch Konfiguratioun vum Erbium.
- 5 Betruecht falsch elektronesch Konfiguratiounen. Et ginn uechtzéng typesch Ausnahmen am Zesummenhang mat den elektronesche Konfiguratioune vun Atomer am niddregsten Energiestatus, och den Terrain Energie Staat genannt. Si befollegen net déi allgemeng Regel nëmmen an de leschten zwou oder dräi Positiounen besat vun Elektronen. An dësem Fall iwwerhëlt déi tatsächlech elektronesch Konfiguratioun datt d'Elektronen an engem Zoustand sinn mat enger niddereger Energie am Verglach mat der Standardkonfiguratioun vum Atom. Ausnahm Atomer enthalen:
- Kr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) an Cm (..., 5f7, 6d1, 7s2).
Tipps
- Fir d'Atomenummer vun engem Atom ze fannen wann se an der elektronescher Konfiguratioun geschriwwe sinn, füügt einfach all d'Zuelen un, déi d'Bréiwer (s, p, d, a f) verfollegen. Dëst funktionnéiert nëmme fir neutral Atomer, wann Dir mat engem Ion ze dinn hutt, da funktionnéiert näischt - Dir musst d'Zuel vun extra oder verluerene Elektronen derbäi oder ofsetzen.
- D'Zuel nom Bréif ass e SuperScript, maacht kee Feeler beim Schecken.
- Et gëtt keng "Stabilitéit vun engem hallef gefëllten" Ënnergrond. Dëst ass eng Vereinfachung. All Stabilitéit, déi sech op déi "hallef gefüllt" Ënnergebidder bezitt, ass wéinst der Tatsaach, datt all Ëmlafbunn vun engem Elektron besat ass, sou datt d'Repulsioun tëscht den Elektronen miniméiert gëtt.
- All Atom tendéiert zu engem stabilen Zoustand, an déi stabilst Konfiguratiounen hunn Ënnerniveau s a p (s2 a p6) gefëllt. Edelgase hunn esou eng Konfiguratioun, dofir gi se selten a Reaktiounen a si lénks op der rietser Säit am Periodesystem. Dofir, wann d'Konfiguratioun op 3p eriwwer ass, brauch se zwee Elektronen fir e stabile Staat z'erreechen (fir sechs ze verléieren, dorënner Elektronen vum s-Sublevel, méi Energie ass erfuerderlech, sou datt et méi einfach ass véier ze verléieren). A wann d'Konfiguratioun op 4d eriwwer ass, da muss se dräi Elektronen verléieren fir e stabile Staat z'erreechen. Zousätzlech sinn hallef gefüllte Subniveauen (s1, p3, d5 ..) méi stabil wéi, zum Beispill, p4 oder p2; allerdéngs sinn s2 a p6 nach méi robust.
- Wann Dir mat engem Ion ze dinn hutt, heescht dat datt d'Zuel vu Protonen net d'selwecht ass wéi d'Zuel vun den Elektronen. An dësem Fall gëtt d'Ladung vun engem Atom uewe riets ugewisen (als Regel) vum chemesche Symbol. Dofir huet en Antimon Atom mat enger Ladung vun +2 d'elektronesch Konfiguratioun 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Notéiert datt 5p op 5p geännert huet. Sief virsiichteg wann d'Konfiguratioun vun engem neutrale Atom op aner Niveaue schléit wéi s a p. Wann Dir Elektronen ophëlt, kënnt Dir se nëmmen aus de Valence Orbitaler ophuelen (s a p Orbitaler).Dofir, wann d'Konfiguratioun op 4s 3d eriwwer ass an den Atom eng +2 Ladung kritt, da wäert d'Konfiguratioun op 4s 3d ophalen. Notéiert w.e.g. datt 3d net verännert, anstatt s-Bunnelektronen ze verléieren.
- Et gi Bedéngungen wann den Elektron gezwongen ass "op e méi héijen Energieniveau ze goen." Wann e Sublevel een Elektron op hallef oder voll Fëllung feelt, huelt een Elektron vun der noosten s oder p-Sublevel a réckelt et an de Sublevel deen en Elektron brauch.
- Et ginn zwou Méiglechkeeten fir eng elektronesch Konfiguratioun opzehuelen. Si kënnen an opsteigend Uerdnung vun den Energieniveau Zuelen oder an der Uerdnung vun der Fëllung vun Elektronenorbitaler geschriwwe ginn, wéi uewe fir Erbium gewise gouf.
- Dir kënnt och d'elektronesch Konfiguratioun vun engem Element opschreiwen andeems Dir nëmmen d'Valence Konfiguratioun opschreift, wat déi lescht s a p Subniveauen ass. Also wäert d'Valenzkonfiguratioun vum Antimon d'Form 5s 5p hunn.
- De Jonah ass net datselwecht. Et ass vill méi schwéier mat hinnen. Skip zwee Niveauen a verfollegt datselwecht Muster ofhängeg vu wou Dir ugefaang hutt a wéi grouss d'Zuel vun den Elektronen ass.