Auteur:
Lewis Jackson
Denlaod Vun Der Kreatioun:
6 Mee 2021
Update Datum:
1 Juli 2024
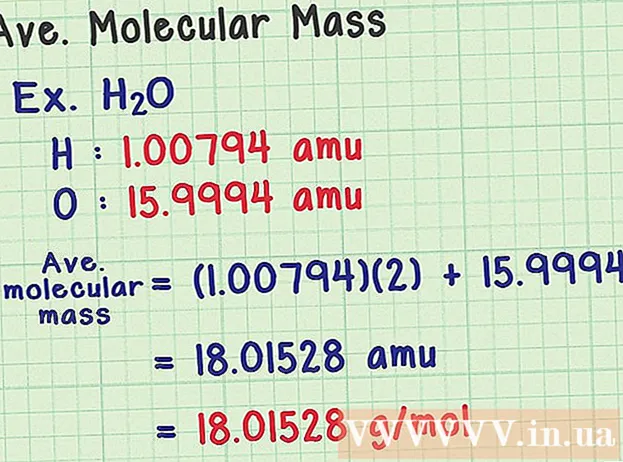
Inhalt
Den Duerchschnëttsmassatoom ass keng direkt Moossnam vun der Mass vun engem Atom. Amplaz ass dëst déi duerchschnëttlech Mass pro Atom aus enger typescher Probe vum Element. Wann Dir d'Masse vu Milliarden eenzel Atomer moosse kënnt, kënnt Dir dëst erausfannen andeems Dir hir Duerchschnëtt berechent. Mir hunn eng méi praktesch Method, déi op Informatioun iwwer déi verschidden Isotopen vum chemeschen Element baséiert.
Schrëtt
Deel 1 vun 2: Berechent den Duerchschnëttsmassatoom
Isotopen a Massatomer verstoen. An der Natur existéieren déi meescht Elementer a ville Formen oder Isotopen. Deen eenzegen Ënnerscheed tëscht zwou Isotopen vum selwechten Element ass d'Zuel vun den Neutronen am Atom, deenen hir Zuel vun den Neutronen de Massatom befaasst. D'Berechnung vum Duerchschnëttsmassatoom berécksiichtegt den Effekt vun dësem Ënnerscheed, a seet Iech déi duerchschnëttlech Mass vun all Atom an enger Probe vun dësen Atomer.
- Zum Beispill, Element Sëlwer (Ag) huet zwee natierlech Isotopen: Ag-107 an Ag-109 (oder Ag an Ag). D'Isotop gëtt no der "Massenzuel" oder der Zomm vun der Zuel vun de Protonen an der Zuel vun den Neutronen an engem Atom benannt. Dat heescht Ag-109 huet zwee méi Neutronen wéi Ag-107, sou datt säin Atom e bësse méi schwéier ass.

Fannt d'Mass vun all Isotop. Dir braucht zwee Informatioune fir all Isotop, Dir kënnt se a Referenzbicher sichen oder online kucken, zum Beispill webelements.com. Déi éischt ass de Massatom oder Atommass vun all Isotop. Isotopen mat méi Neutronen hu méi Mass.- Zum Beispill huet de sëlwer Isotop Ag-107 de Massatom 106.90509 amu (d'Eenheet vun engem kubesche Atom). Isotop Ag-109 ass liicht méi schwéier mat Mass vun 108,90470.
- D'Paar vun Dezimalzuelen um Enn kann an den Dokumenter liicht anescht sinn. Schreift keng Zuelen tëscht Klammern no der Mass.

Schreift déi natierlech Iwwerliewensquote fir all Isotop. Dëst Verhältnes weist d'Prävalenz vun der Isotop un, als Prozentsaz vun den Total Atomer vum Element. Dir fannt dës Informatioun am selwechten Dokument mat engem kubesche Atom drop. Natierlech Iwwerliewe vun allen Isotopen soll 100% sinn (och wann et duerch de Feeler beim Ronnen e bëssen ënnerscheede kann).- Ag-107 Isotop huet d'Verhältnis vun 51,86%. D'Isotop Ag-109 ass manner heefeg mat engem Taux vun 48,14%. Dat heescht datt eng normal Sëlwer Probe 51,86% Ag-107 an 48,14% Ag-109 huet.
- All Isotopen déi dës Iwwerliewensquote net hunn, ginn ignoréiert. Dës Isotopen existéieren net natierlech op der Äerd.

Konvertéiert den Isotop-Prozentsaz op eng Dezimalzuel. Deelt dëst Verhältnis op 100 gëtt dee selwechte Wäert wéi en Dezimalzuel.- An der Sëlwer Probe uewen ass d'Verhältnis vun Isotopen 51,86 / 100 = 0,5186 an 48,14 / 100 = 0,4814.
Fannt den duerchschnëttleche kubesche Atom. Den Duerchschnëttsmassatoom vun engem Element huet n Isotopen gläich (Atomic BlockIsotop 1 * VerhältnisIsotop 1) + (AtommassIsotop 2 * VerhältnisIsotop 2) + ... + (AtommassIsotopen n * VerhältnisIsotopen n. Dëst ass e Beispill vun enger "Duerchschnëttsmass", dat heescht datt wat d'Iwwerliewensquote vun der Isotop méi grouss ass, wat hiren Effekt op d'Resultat méi grouss ass. Wéi dës Formel fir Sëlwer unzewenden ass wéi follegt:
- Medium Mass AtomAg = (MassatomAg-107 * VerhältnisAg-107) + (AtommassAg-109 * VerhältnisAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Fannt dat Element op der periodescher Tabelle fir d'Resultater ze kontrolléieren. Den duerchschnëttleche kubesche Atom gëtt ëmmer ënner dem chemesche Symbol vum Element geschriwwen.
- Medium Mass AtomAg = (MassatomAg-107 * VerhältnisAg-107) + (AtommassAg-109 * VerhältnisAg-109)
Deel 2 vun 2: Benotzt Resultater
Mass zu atomarer Zuel konvertéieren. Den Duerchschnëttsmassatoom weist d'Bezéiung tëscht Mass an der Zuel vun Atomer an enger typescher Probe vun deem Element. Dëst ass ganz nëtzlech a chemesche Laboratoiren, well et bal onméiglech ass, Atomer genee ze zielen, awer d'Masse sinn einfach ze bestëmmen. Zum Beispill kënnt Dir e Probe vu Sëlwer weien a wësse datt et ee Sëlweratom gëtt fir all 107.8677 Amu.
Konvertéiert a Molmass. D'Atommass Eenheet ass ganz kleng, sou datt Chemiker dacks d'Gramm Eenheet fir Mass benotzen. Glécklech hu mir Definitioune vun dëse Konzepter sou datt d'Transformatioun einfach soll sinn. Multiplizéiert just den Duerchschnëttsmassatoom mat 1 g / mol (molmassekonstant) fir e Resultat am g / mol ze kréien. Zum Beispill, 107.8677 Gramm Sëlwer enthält eng Mol Sëlweratomer.
Fannt déi duerchschnëttlech Molekularmass. Well eng Molekül eng Sammlung vun Atomer ass, kënnt Dir d'Mass vun all Atomer bäifügen fir d'Molekularmass ze fannen. Wann Dir en duerchschnëttlecht Massatom benotzt (anstatt d'Mass vun engem bestëmmten Isotop), wier d'Resultat déi duerchschnëttlech Molekularmass vun enger Probe an der Natur. Hei ass e Beispill:
- Eng Waassermolekül huet déi chemesch Formel H2O enthält zwee Waasserstoffatomer (H) an ee Sauerstoff (O) Atom.
- Waasserstoff huet en duerchschnëttlecht Massatom vun 1,00794 amu. Sauerstoff huet eng duerchschnëttlech Atommass vu 15.9994 Amu.
- Also déi duerchschnëttlech Molekularmass vun H2O ass gläich wéi (1,00794) (2) + 15,9994 = 18,01528 amu, wat entsprécht 18,01528 g / mol.
Berodung
- D'Konzept vun der relativer Atommass gëtt heiansdo synonym mat engem duerchschnëttleche Massatom benotzt. Et ass e klengen Ënnerscheed well d'Atommass relativ eng Eenheet ass; et ass eng Miessung vun der Mass relativ zu engem Kuelestoff-12 Atom. Soulaang Dir d'Atommasseenheet an der duerchschnëttlecher kubescher Atomberechnung benotzt, sinn dës zwou Wäerter d'selwecht.
- D'Zuel tëscht Klammern nom Kubikatom seet eis de Feeler. Zum Beispill, Massatom 1.0173 (4) bedeit datt den normalen Atom vum Element e Massegebitt vun ongeféier 1.0173 ± 0.0004 huet. Dir braucht dës Zuel net ze kréien wann se net gefrot gëtt.
- Op dem periodeschen Dësch ass den duerchschnëttleche kubesche Atom vum folgenden Element méi grouss wéi dee virdrun, mat e puer Ausnahmen. Hei ass e schnelle Wee fir Är Resultater ze kontrolléieren.
- 1 Atommasseenheet ass 1/12 d'Mass vun engem Kuelestoff-12 Atom.
- D'Isotop Iwwerliewensraten ginn no typeschen natierlech virkommen Echantillonen op der Äerd berechent. Net-natierlech optriede Substanze wéi Meteoritten oder eng Substanz déi an engem Laboratoire produzéiert kënne verschidden Isotop-Verhältnisser hunn, sou datt den duerchschnëttleche Massatom och anescht ass.
Opgepasst
- Massatomer ginn ëmmer an Atommasseenheeten (amu oder u) geschriwwen, heiansdo Dalton genannt (Da). Schreift ni eng aner Masseenheet (wéi e Kilogramm) no dëser Zuel ouni se z'änneren.
Wat Dir braucht
- Bläistëft
- Pabeier
- Laptop
- Daten iwwer d'Isotop Iwwerliewensquote an der Natur.
- Masseatomen Eenheetsdate fir Isotopen.