Auteur:
Lewis Jackson
Denlaod Vun Der Kreatioun:
12 Mee 2021
Update Datum:
1 Juli 2024
Inhalt
Elektronekonfiguratioun vun engem Atom ass eng Serie vun Zuelen déi d'Elektronëmlafbunne representéieren. Elektronen Obitaner sinn déi raimlech Regioune vu verschiddene Formen, déi en Atomkär ëmginn, an deem Elektronen op eng uerdentlech Aart a Weis arrangéiert sinn. Duerch Elektronekonfiguratioun kënnt Dir séier bestëmmen wéi vill Elektronenorbitalen am Atom sinn, an d'Zuel vun Elektronen an all Orbit. Wann Dir d'Grondprinzipie vun der Elektronekonfiguratioun verstanen hutt, kënnt Dir Är eege Elektronekonfiguratioun schreiwen a fäeg sinn chemesch Tester mat Vertrauen ze maachen.
Schrëtt
Method 1 vun 2: Bestëmmt d'Zuel vun den Elektronen mat enger chemescher periodescher Tabell
Fannt d'Atomnummer vum Atom. All Atom huet eng spezifesch Zuel vun Elektronen domat verbonnen. Situéiert d'Element op dem periodeschen Dësch. D'Atomzuel ass eng positiv ganz Zuel, déi bei 1 (fir Waasserstoff) ufänkt a vun 1 fir all Atom duerno eropgeet. D'Atomzuel ass d'Zuel vu Protonen vum Atom - also ass et och d'Zuel vun Elektronen vum Atom am Buedemzoustand.
- Bestëmmt d'Laascht vum Atom. En elektrescht neutralt Atom huet déi richteg Unzuel vun Elektronen, wéi et um periodeschen Dësch gewise gëtt. Wéi och ëmmer, en Atom mat enger Ladung wäert méi oder manner Elektronen hunn op Basis vu senger Ladegréisst. Wann Dir mat Atomer mat enger Ladung schafft, addéiert oder subtrahéiert déi entspriechend Unzuel vun Elektronen: füügt een Elektron fir all negativ Ladung a subtrahéiert en Elektron fir all Positiv Ladung.
- Zum Beispill, en Natriumatom mat enger Ladung vu +1 wäert een Elektron aus der Basis atomarer Nummer 11. Ewechhuelen, Dofir wäert den Natriumatom am Ganzen 10 Elektronen hunn.
- Memoriséiert déi Basis Bunnlëscht. Wann en Atom Elektronen kritt, ginn dës Elektronen an Orbitalen an enger spezifescher Reiefolleg arrangéiert. Wann d'Elektronen Orbitaler fëllen, ass d'Zuel vun den Elektronen an all Bunn gläich. Mir hunn folgend Orbitalen:
- Obitan s (all Zuel mat engem "s" hannendrun an der Elektronekonfiguratioun) huet nëmmen een Orbit, a befollegt De Pauli Ausnamen PrinzipAll Ëmlaf enthält maximal 2 Elektronen, sou datt all Orbital nëmmen 2 Elektronen enthält.
- Obitan p huet 3 Orbitalen, sou datt et bis zu 6 Elektronen hale kann.
- Obitan d huet 5 Orbitalen, sou datt et bis zu 10 Elektronen hale kann.
- Obitan f huet 7 Orbitalen, kann also bis zu 14 Elektronen halen. Memoriséieren d'Reiefolleg vun den Orbitalen no folgendem gefaangene Saz:
San Paggressiv Däh FOkay Gdomm HUps ÍKEch kommen.
Fir Atomer mat méi Elektronen, ginn Orbitale weider alphabetesch nom Buschtaf k geschriwwe, wouduerch d'Charaktere déi benotzt goufen.
- Elektronekonfiguratioun verstoen. Elektronekonfiguratiounen gi geschriwwen fir kloer d'Zuel vun Elektronen am Atom ze weisen, souwéi d'Zuel vun Elektronen an all Bunn. All Bunn gëtt an enger bestëmmter Reiefolleg geschriwwen, mat der Zuel vun Elektronen an all Bunn, déi iwwer dem Recht vum Bunnnumm geschriwwe sinn. Schlussendlech ass d'Elektronekonfiguratioun eng Sequenz déi aus den Nimm vun den Orbitalen an der Zuel vun den Elektronen uewe riets geschriwwe steet.
- Déi folgend Beispill ass eng einfach Elektronekonfiguratioun: 1s 2s 2p. Dës Konfiguratioun weist datt et zwou Elektronen an der 1s Bunn sinn, zwee Elektronen an der 2s Bunn, a sechs Elektronen am 2p Bunn. 2 + 2 + 6 = 10 Elektronen (total). Dës Elektronekonfiguratioun ass fir en elektrescht neutralen Neonatom (d'Atomnummer vum Neon ass 10).
- Memoriséieren d'Bestellung vun den Orbitalen. Bedenkt datt d'Orbitalen no der Elektroneklasse nummeréiert sinn, awer energesch bestallt sinn. Zum Beispill ass de 4s Orbit mat enger gerénger Energie (oder méi haltbar) saturéiert wéi de saturéierten oder ongesiedegten 3D Orbit, sou datt d'4s Ënnerklass als éischt geschriwwe gëtt. Wann Dir d'Bestellung vun den Orbitale wësst, kënnt Dir d'Elektronen an hinnen arrangéieren no der Unzuel vun Elektronen am Atom. Den Optrag fir Elektronen an Orbitaler ze placéieren ass wéi follegt: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- D'Elektronekonfiguratioun vun engem Atom mat all elektrongefëllten Ëmlafbunn gëtt sou geschriwwen: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Bedenkt datt wann all d'Schichten ausgefëllt sinn, ass déi uewe genannten Elektronekonfiguratioun déi vum Og (Oganesson), 118, dat ass deen héchsten nummeréierten Atom op dem periodeschen Dësch - enthält all aktuell bekannt Elektroneschichten fir mat engem elektreschen neutralen Atom.
- Sortéiert Elektronen an Orbitalen no der Unzuel vun Elektronen am Atom. Zum Beispill, wann Dir d'Elektronekonfiguratioun vum elektreschen neutralen Kalziumatom schreiwe wëllt, ass dat éischt wat Dir maache musst seng Atomnummer op der Periodescher Tabelle ze fannen. D'Atomzuel vu Kalzium ass 20, sou datt mir d'Konfiguratioun vun engem Atom mat 20 Elektronen an der Uerdnung schreiwen.
- Setzt Är Elektronen an Orbitalen an der Uerdnung uewen bis Dir 20 Elektronen erreecht hutt. Obitan 1s kritt zwee Elektronen, 2s kritt zwee, 2p kritt sechs, 3s kritt zwee, 3p kritt sechs, a 4s kritt zwee (2 + 2 + 6 +2 +6 + 2 = 20). Dofir ass d'Elektronekonfiguratioun vu Kalzium: 1s 2s 2p 3s 3p 4s.
- Notiz: Den Energieniveau ännert sech wann d'Elektroneschicht eropgeet. Zum Beispill, wann Dir op de 4. Energieniveau schreift, gëtt d'4s Ënnerklass als éischt geschriwwen, méi spéit op 3d. Nodeems Dir de véierten Energieniveau geschriwwen hutt, fuert Dir op de fënneften Niveau a fänkt d'Schichtungsuerdnung nei un. Dëst geschitt nëmmen nom 3. Energieniveau.
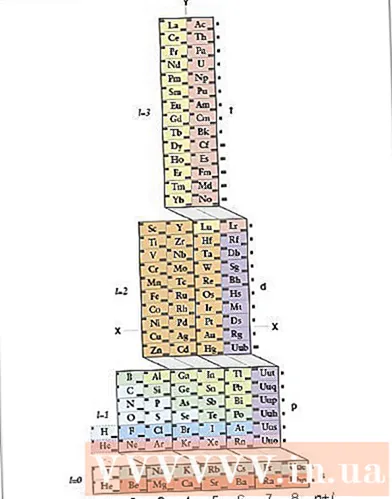
- Benotzt d'Periodesch Tabelle als visuell Ofkierzung. Dir hutt vläicht gemierkt datt d'Form vum periodeschen Dësch der Uerdnung vun den Orbitalen an der Elektronekonfiguratioun entsprécht. Zum Beispill, Atomer an der zweeter lénkser Kolonn enden ëmmer bei "s", Atomer op der rietser rietser Säit vum mëttleren Deel ëmmer bei "d", asw. Benotzt de periodesche System fir Strukturen ze schreiwen. Figur - d'Reiefolleg wéi d'Elektronen an Orbitaler plazéiert sinn entspriechen de Positiounen déi um periodesche Dësch gewise ginn. Kuckt ënnen:
- Déi zwou lénkskolonne sinn Atomer, deenen hir Elektronekonfiguratioun an der Ëmlaf ass, de richtegen Deel vun der periodescher Tabell ass Atomer mat enger Elektronekonfiguratioun, déi an der P Orbital endet, de mëttleren Deel ass Atomer, déi an der Ëmlaf enden. d, an drënner sinn d'Atomer, déi um f Orbital enden.
- Zum Beispill, wann Dir eng Elektronekonfiguratioun vum Element Chlor schreift, maacht folgend Argument: Dësen Atom steet an der drëtter Zeil (oder "Period") vum periodesche System. Et ass och an der fënnefter Kolonn vum p Orbitalblock um periodeschen Dësch. Also d'Elektronekonfiguratioun wäert um Enn sinn ... 3p.
- Opgepasst! D'd an f Ëmlafklassen op dem periodeschen Dësch entspriechen den Energieniveauen anescht wéi hir Period. Zum Beispill entsprécht déi éischt Zeil vum d Orbitalblock dem 3d Orbit och wann et an der Period 4 ass, wärend déi éischt Zeil vum f Orbital dem 4f Orbit entsprécht och wann et an der Period 6 ass.
- Léiert wéi een zesummeklappbar Elektronekonfiguratiounen schreift. D'Atomer laanscht de richtege Rand vun der periodescher Tabell ginn genannt seelen Gas. Dës Elementer si chemesch ganz inert. Fir déi laang Elektronekonfiguratioun ze verkierzen, schreift a véiereckege Klammen dat chemescht Symbol fir deen nooste rare Gas dee manner Elektronen huet wéi dee vum Atom, a schreift weider d'Elektronekonfiguratiounen vun den nächsten Orbitalen. . Kuckt ënnen:
- Fir dëst Konzept ze verstoen, schreift e Beispill eng zesummegebrach Elektronekonfiguratioun. Ugeholl mir mussen d'Elektronekonfiguratioun fir Zinkreduktioun (Atomnummer 30) duerch eng rar Gaskonfiguratioun schreiwen. D'Zénk voll Elektronekonfiguratioun ass: 1s 2s 2p 3s 3p 4s 3d. Bedenkt awer datt 1s 2s 2p 3s 3p d'Konfiguratioun fir de rare agonesche Gas ass. Ersetzt just dësen Deel vun der Zinker Elektronennotatioun mam agonesche chemesche Symbol a véiereckege Klammen ().
- Dofir ass d'Elektronekonfiguratioun vun Zink kompakt 4s 3d.
Method 2 vun 2: Benotzt de periodeschen Dësch ADOMAH

Entdeckt d'ADOMAH periodesch Tabelle. Dës Method fir Elektronekonfiguratioun ze schreiwen erfuerdert keng Memorisatioun. Wéi och ëmmer, dës Method erfuerdert eng nei arrangéiert periodesch Tabelle, well an enger regulärer periodescher Tabelle, zënter der véierter Zeil, d'Zuel vun den Zyklen net der Elektroneschicht entsprécht. Fannt eng ADOMAH Periodesch Tabell, eng speziell chemesch Periodesch Tabelle entwéckelt vum Wëssenschaftler Valery Tsimmerman. Dir fannt dës periodesch Tabelle um Internet.- Op der ADOMAH Periodic Table sinn d'horizontal Reihen Gruppen vun Elementer wéi Halogenen, Inertgasen, Alkalimetaller, Alkalimetaller asw. Déi vertikal Säulen entspriechen der Elektroneschicht a gi "rungs" genannt (diagonal Kräizungen). Block s, p, d an f) entspriechen der Period.
- Helium gëtt nieft Waasserstoff arrangéiert well béid en eenzegaartegen 1s Orbit hunn. Déi periodesch Blocken (s, p, d an f) ginn op der rietser Säit gewisen an d'Zuel vun Elektroneschichten gëtt un der Basis gewisen. Element Nimm ginn an e Rechteck geschriwwen nummeréiert 1 bis 120. Dës Zuelen sinn déi üblech Atomzuelen, déi d'Gesamtzuel vun Elektronen an engem elektresch neutralen Atom duerstellen.
- Fannt Elementer op der periodescher Tabelle ADOMAH. Fir eng Elektronekonfiguratioun fir en Element ze schreiwen, lokaliséiert säi Symbol op der ADOMAH Periodic Table a streckt all Elementer mat méi héijen Atomzuelen duerch. Zum Beispill, wann Dir d'Elektronekonfiguratioun vun eribi (68) schreiwe wëllt, da streckt d'Elementer 69 bis 120 duerch.
- Notéiert d'Zuelen 1 bis 8 un der Basis vum Periodesch Dësch. Dëst ass d'Zuel vun Elektroneschichten oder Säulen. Passt net op Spalten op, déi nëmmen Elementer duerchgestrachen hunn.Fir Eribi sinn déi verbleiwen Säulen 1, 2, 3, 4, 5 a 6.
- Zielt d'Zuel vun den Orbitalen op d'Positioun vum Atom fir d'Konfiguratioun ze schreiwen. Kuckt d'Blocknotatioun riets vun der periodescher Tabelle (s, p, d an f) a kuckt d'Zuel vun de Säulen, déi un der Basis vum Dësch gewise ginn, onofhängeg vun der diagonaler tëscht de Blocken, deelt d'Kolonn a Kolonneblocken a schreift si sinn an der Rei vun ënnen no uewen. Ignoréiert Spaltblocken déi nëmmen duerchgestrachen Elementer enthalen. Schreift d'Kolonnblocken unzefänken mat der Kolonnennummer an dann de Blocksymbol, sou: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (am Fall vun Eribi).
- Notiz: Déi uewe genannten Elektronekonfiguratioun fir Er ass an opsteigender Reiefolleg vun der Unzuel vun Elektroneschichten geschriwwen. Dës Konfiguratioun kann och an der Reiefolleg geschriwwe ginn fir Elektronen an Orbitalen ze placéieren. Gitt weg d'Schrëtt vun uewen no ënnen amplaz vu Säulen beim Schreiwe vun de Spalteblocken: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Zielt d'Zuel vun Elektronen pro Bunn. Zielt d'Zuel vun den Elektronen, déi net an all Kolonneblock ausgestreckt sinn, zielt een Elektron pro Element a schreift d'Zuel vun Elektronen niewent dem Blocksymbol fir all Blockkolonn, sou: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. An dësem Beispill ass dëst d'Elektronekonfiguratioun vum Eribi.
- Anormal Elektronekonfiguratiounen erkennen. Et ginn uechtzéng allgemeng Ausnamen zu der Elektronekonfiguratioun vun Atomer am niddregsten Energiestaat, och bekannt als Grondzoustand. Am Verglach mat der allgemenger Daumregel, déviéiere se nëmmen vun de leschten zwee bis dräi Elektronepositiounen. An dësem Fall verursaacht déi tatsächlech Elektronekonfiguratioun d'Elektronen e méi nidderegen Energiestand wéi déi Standardkonfiguratioun vum Atom. Déi ongewéinlech Atomer sinn:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo. (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gott (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) an Cm (..., 5f7, 6d1, 7s2).
Berodung
- Wann den Atom en Ion ass, heescht et datt d'Zuel vun de Protonen net gläich der Zuel vun den Elektronen ass. D'Ladung vum Atom gëtt dann an der (normalerweis) ieweschter rechter Ecke vum Element Symbol gewisen. Dofir huet en Antimonatom mat Ladung +2 eng Elektronekonfiguratioun vun 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Bedenkt datt 5p op 5p geännert gëtt. Sief virsiichteg wann d'Konfiguratioun vun engem elektreschen neutralen Atom an all Orbitalen ausser s an p endet. Mat Elektronen ewechgeholl, kënnt Dir nëmmen Elektronen aus de Valensorbitalen (s an p Orbitalen) huelen. Also wann eng Konfiguratioun op 4s 3d endet, an den Atom huet eng Charge vun +2, ännert d'Konfiguratioun op 4s 3d. Mir gesinn 3dkonstant, awer nëmmen Elektronen an der Ëmlafbunn ginn ewechgeholl.
- All Atomer tendéieren zréck an e stabilen Zoustand, an déi stabilst Elektronekonfiguratioun wäert genuch s a p Orbitalen (s2 a p6) hunn. Dës selten Gasen hunn dës Elektronekonfiguratioun, dofir si seelen u Reaktiounen deel a sinn op der rietser Säit vum periodeschen Dësch. Also wann eng Konfiguratioun um 3p endet, brauch et nëmmen zwee méi Elektronen fir stabil ze ginn (sechs Elektronen ofginn, inklusiv den Elektronen vun der Ëmlafbunn, géif méi Energie brauchen, sou datt véier Elektronen ofginn, wier méi einfach. méi einfach). Wann eng Konfiguratioun op 4d endet, brauch se nëmmen dräi Elektronen ofzeginn fir e stabillen Zoustand z'erreechen. Ähnlech sinn déi nei Ënnerklassen, déi d'Halschent vun den Elektronen (s1, p3, d5 ..) kréien, méi stabil, zB p4 oder p2, awer s2 a p6 wäerte nach méi stabil sinn.
- Dir kënnt och d'Valence Elektronen Konfiguratioun benotze fir d'Elektronen Konfiguratioun vun engem Element ze schreiwen, wat déi lescht s an p Orbitalen ass. Dofir ass d'Valenzkonfiguratioun vun engem Antimonatom fir en Antimon 5s 5p.
- Ionen hunn dat net gär well se vill méi haltbar sinn. Iwwerspréngt déi uewe genannte Schrëtt vun dësem Artikel a schafft déiselwecht Manéier, ofhängeg vu wou Dir ufänkt a wéi vill oder manner Elektronen Dir hutt.
- Fir d'Atomzuel vu senger Elektronekonfiguratioun ze fannen, füügt all d'Nummeren bäi déi d'Buchstawen (s, p, d, a f) verfollegen. Dëst ass nëmme richteg wann et en neutralen Atom ass, wann et en Ion ass, da kënnt Dir dës Method net benotzen. Amplaz, musst Dir d'Zuel vun den Elektronen, déi Dir hëlt oder ofgitt, bäifügen oder zéien.
- D'Nummer nom Bréif muss an der ieweschter rechter Ecke geschriwwe ginn, Dir däerft net falsch schreiwen wann Dir den Test maacht.
- Et ginn zwou verschidde Weeër fir Elektronekonfiguratiounen ze schreiwen. Dir kënnt an der opsteigender Reiefolleg vun der Elektroneschicht schreiwen, oder an der Reiefolleg wéi d'Elektronen an Orbitaler plazéiert sinn, wéi fir den Eribi Atom gewisen.
- Et gi Fäll wou en Elektron muss "eropgedréckt" ginn. Dat ass wann en Orbit nëmmen een Elektron fehlt fir d'Halschent oder all vun den Elektronen ze hunn, da musst Dir en Elektron aus dem nooste s oder p Orbital huelen fir en an den Orbit ze transferéieren deen deen Elektron brauch.
- Mir kënnen net soen datt d '"Energiefraktiounsstabilitéit" vun der Ënnerklass d'Halschent vun den Elektronen kritt. Dat ass eng ze vereinfacht. De Grond fir d'Stabilitéit vum Energieniveau vun der neier Ënnerklass, déi "d'Halschent vun den Elektronen" kritt, ass datt all Bunn nëmmen een eenzegen Elektron huet, sou datt d'Elektronen-Elektronen Ofstouss miniméiert gëtt.



