Auteur:
Monica Porter
Denlaod Vun Der Kreatioun:
22 Mäerz 2021
Update Datum:
1 Juli 2024
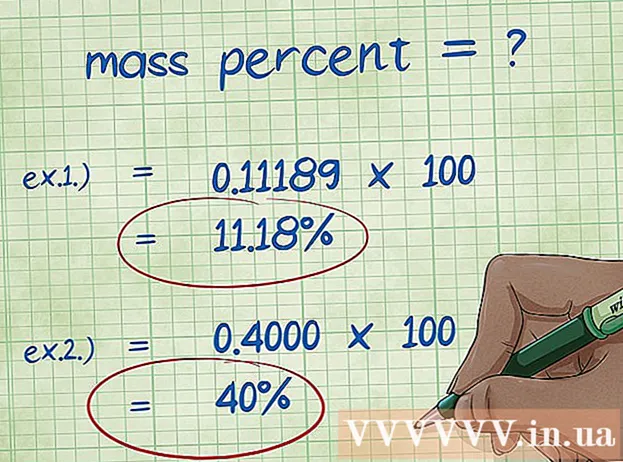
Inhalt
Masseprozent weist de Prozentsaz vun all Element an enger chemescher Verbindung un. Fir de Masseprozent ze fannen, muss een d'molare Mass vun den Elementer an der Verbindung a Gramm / Mol kennen oder d'Zuel vu Gramm vun de Substanzen, déi d'Léisung ausmaachen. De Masseprozent gëtt mat enger einfacher Formel berechent déi d'Mass vum Element (oder opgeléist) deelt mat der Mass vun der Verbindung (oder Léisung).
Schrëtt
Method 1 vun 2: Berechent Mass Prozentsaz wëssen Mass
Bestëmmt d'Gleichung fir de Prozentsaz vun der Mass an der Mëschung. D'Basisformel fir de Masseprozent am Mix ze berechnen ass: Masseprozent = (Qualitéitsmass / gemëschte Mass) x 100. Endlech musst Dir mat 100 multiplizéieren fir de Prozentsaz duerzestellen.
- Schreift eng Equatioun wann Dir ufänkt de Problem ze léisen: Masseprozent = (Substanzmass / gemëschte Mass) x 100.
- De Betrag vun der Qualitéit gëtt am Problem uginn. Wann d'Thema net gëtt, bezitt Iech op déi folgend Sektioun wéi Dir Masseprozenter fënnt ouni Gewiichter ze kennen.
- D'Mass vun der Mëschung ass gläich wéi d'Gesamtmass vun de Substanzen déi d'Mëschung oder d'Léisung ausmaachen.

Berechent d'Mass vun der Mëschung. Wann Dir d'Massen vun den Elementer oder Verbindungen wësst, braucht Dir se nëmmen ze addéieren fir d'Mass vun der definitiver Mëschung oder der Léisung ze kréien. Dëst ass den Nenner an der Formel fir Prozentsaz Mass.- Beispill 1: Wat ass de Masseprozent vu 5 g Natriumhydroxid wa se mat 100g Waasser opgeléist gëtt?
- D'Mass vun der Mëschung ass déi total Mass vun Natriumhydroxid a Waasser: 100g + 5g. Also déi gemëschte Mass ass 105g.
- Beispill 2: Wéi eng Mass vun Natriumchlorid a Waasser ass erfuerderlech fir 175g eng 15% Léisung ze bilden?
- An dësem Beispill, wou Dir déi gemëschte Mass an de Masseprozent kennt, freet d'Aufgab d'Mass vum addéierte Solut ze fannen. D'Mass vun der Mëschung ass 175 g.
- Beispill 1: Wat ass de Masseprozent vu 5 g Natriumhydroxid wa se mat 100g Waasser opgeléist gëtt?

Bestëmmt d'Mass vun der Substanz fir de Prozentsaz Mass ze fannen. Wann de Quiz freet de "Masseprozent" vun enger Substanz ze fannen, musst Dir d'Mass vun der Substanz als Prozentsaz vun der Gesamtmass vun allen Zutaten fannen. Schreift d'Mass vun der Substanz op fir de Prozentsaz Mass ze fannen. Dëst ass den Teller an der Formel fir Prozentsaz Mass.- Beispill 1: D'Mass vun Natriumhydroxid (Substanz ze fannen duerch Massefraktioun) ass 5g.
- Beispill 2: An dësem Beispill sicht d'Quantitéit vun der Substanz de Prozentsaz vun der onbekannter Mass, an Dir sicht no.

Ersetzt d'Variabelen mat der Masseprozentsgleichung. Wann Dir de Wäert vun all Variabel bestëmmt hutt, steck se einfach an d'Gleichung.- Beispill 1: Masseprozent = (Substanzmass / gemëschte Mass) x 100 = (5 g / 105 g) x 100.
- Beispill 2: Mir mussen d'Masseprozentsgleichung konvertéieren fir d'Quantitéit vun onbekannter Qualitéit ze berechnen: Qualitéitsmass = (Prozent Mass * gemëschte Mass) / 100 = (15 * 175) / 100 .
Berechent de Volume Prozentsaz. Elo datt d'Gleichung ausgefëllt ass, musst Dir just de Masseprozent ausrechnen. Deelt d'Mass vun der Substanz duerch d'Mass vun der Mëschung, multiplizéiert se dann mat 100. Dëst ass de Masseprozent vun der Substanz an der Mëschung.
- Beispill 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Dofir ass de Masseprozent vu 5 g Natriumhydroxid opgeléist an 100g Waasser 4.761%.
- Beispill 2: D'Gleichung nom Ëmrechnung fir d'Qualitéitsquantitéit ze berechnen ass (Prozentsaz Mass * gemëscht Gewiicht) / 100: (15 * 175) / 100 = (2625) / 100 = 26,25 Gramm Natriumchlorid.
- D'Gewiicht vum addéierte Waasser ass d'Mass vun der Mëschung minus d'Gewiicht vun der Substanz: 175 - 26,25 = 148,75 Gramm Waasser.
Method 2 vun 2: Berechent Masseprozent wann d'Mass onbekannt ass
Bestëmmt d'Gleichung fir de Prozentsaz vun der Mass an der Verbindung. D'Basisformel fir d'Berechnung vum Masseprozent an enger Verbindung ass: Masseprozent = (Elementar Molmass / Molmass vun der Verbindung) x 100. Elementar Molmass ass d'Mass vun enger Mol Element wärend molekulare Mass d'Mass vun enger Mol Verbindung ass. Schlussendlech musst Dir mat 100 multiplizéieren fir de Prozentsazwäert ze kréien.
- Schreift eng Equatioun wann Dir ufänkt de Problem ze léisen: Masseprozent = (Elementar Molmass / Molmass vu Verbindung) x 100.
- D'Eenheete vun den zwou genannte Wäerter si Gramm pro Mol (g / mol).
- Wann de Problem keng Mass gëtt, kënnt Dir d'Molermass benotze fir de Masseprozent vum Element ze berechnen.
- Beispill 1: Berechent de Masseprozent vu Waasserstoff an enger Waassermolekül.
- Beispill 2: Berechent de Masseprozent vu Kuelestoff an enger Glukosemolekül.
Schreift Chemesch Formel. Wann de Problem d'chemesch Formelen fir all Verbindung net ofdeckt, musst Dir se opschreiwen. Wann de Problem fir d'chemesch Formel ass, sprange dëse Schrëtt a gitt op "Fannt d'Mass vun all Element" Schrëtt.
- Beispill 1: Schreift d'chemesch Formel fir Waasser, H2O.
- Beispill 2: Schreift d'chemesch Formel fir Glukos, C6H12O6.
Fannt d'Mass vun all Element an der Verbindung. Kuckt d'Molekulargewiicht vun all Element an der chemescher Formel op dem periodeschen Dësch. Déi elementar Mass gëtt normalerweis ënner dem chemesche Symbol geschriwwen. Schreift d'Mass vun all Element an der Verbindung op.
- Beispill 1: Mir kënne feststellen datt de Massatoom vum Sauerstoff 15.9994 ass; an de kubesche Atom vu Waasserstoff ass 1.0079.
- Beispill 2: Mir hu festgestallt datt de Massatoom vu Kuelestoff 12.0107 ass; Sauerstoff ass 15.9994; an de Waasserstoff ass 1,0079.
Multiplizéiert de kubesche Atom mam Molverhältnis. Bestëmmt d'Zuel vu Mol (Molverhältnis) vun all Element an der chemescher Verbindung. De Molverhältnis gëtt vun der klenger Zuel ënnen an der chemescher Formel vun der Verbindung berechent. Multiplizéiert de kubesche Atom vun all Element mam Molverhältnis.
- Beispill 1: Waasserstoff huet en Ënnerschrëft vun zwee wärend Sauerstoff en Ënnerschrëft vun 1. Also multiplizéiert d'Molekulargewiicht vu Waasserstoff mat 2, 1.00794 X 2 = 2.01588; an d'molekular Mass vu Sauerstoff ass 15.9994 (multiplizéiert mat engem).
- Beispill 2: Kuelestoff huet en Ënnerschrëft vu 6, Waasserstoff ass 12, a Sauerstoff ass 6. Multiplizéiert de Kubikatom vun all Element mam Index hei drënner.
- Kuelestoff (12.0107 * 6) = 72.0642
- Waasserstoff (1,00794 * 12) = 12,09528
- Sauerstoff (15.9994 * 6) = 95.9964
Berechent d'total Mass vun der Verbindung. Füügt d'Massen vun allen Elementer an der Verbindung bäi. Dir kënnt d'Gesamtmass vu Verbindungen ausrechnen mat de Massen ausgedréckt a mol Verhältnisser. Dës Zuel wäert den Nenner an der Prozentsaz Massenequatioun sinn.
- Beispill 1: Füügt 2.01588 g / mol (d'Mass vun zwee Mol Waasserstoffatomer) op 15.9994 g / mol (d'Mass vun engem Mol Sauerstoffatomer) gëtt 18.01528 g / mol.
- Beispill 2: Füügt all d'Gewichte mateneen: Kuelestoff + Waasserstoff + Sauerstoff = 72.0642 + 12.09528 + 95.9964 = 180.156 g / mol.
Bestëmmt déi elementar Mass op déi de Masseprozent soll berechent ginn. Wann de Problem no "Masseprozent" freet, heescht et datt Dir d'Mass vun engem bestëmmten Element an der Verbindung als Prozentsaz vun der Gesamtmass vun allen Elementer muss fannen. Bestëmmt a schreift d'Mass vum Element op. Dës Mass ass d'Mass ausgedréckt am Molverhältnis. Dës Zuel ass den Teller vun der Massevergleichung.
- Beispill 1: D'Mass vum Waasserstoff an enger Verbindung ass 2.01588 g / mol (d'Mass vun zwee Mol Waasserstoffatomer).
- Beispill 2: D'Mass vu Kuelestoff an enger Verbindung ass 72.0642 g / mol (d'Mass vu sechs Mol Kuelestoffatomer).
Ersetzt d'Variabelen an d'Masseprozentsgleichung. Nodeems Dir d'Wäerter vun all Variabel bestëmmt hutt, ersetzt se einfach mat der am éischte Schrëtt identifizéierten Equatioun: Masseprozent = (Elementar Molmass / Molmass vun der Verbindung) x 100 .
- Beispill 1: Masseprozent = (Elementar Molmass / Molmass vun der Verbindung) x 100 = (2,1588 / 18,1528) x 100.
- Beispill 2: Masseprozent = (Elementar Molmass / Molmass vun der Verbindung) x 100 = (72,0642 / 180,156) x 100.
Berechent de Volume Prozentsaz. Elo wou d'Gleichung ausgefëllt ass, musst Dir just de Masseprozent ausrechnen. Deelt d'Mass vum Element mat der Gesamtmass vun der Verbindung, multiplizéiert se dann mat 100. Dëst ass de Prozentsaz vun der Mass vum Element an der Verbindung.
- Beispill 1: Masseprozent = (2.01588 / 18.01528) x 100 = 0.111189 x 100 = 11.18%. Dofir ass de Masseprozent vum Waasserstoffatom am Waassermolekül 11,18%.
- Beispill 2: Masseprozent = (Elementar Molmass / Molmass vun der Verbindung) x 100 = (72,0642 / 180,156) x 100 = 0,4000 x 100 = 40,00%. Also ass de Masseprozent vum Kuelestoffatoom an der Glukosemolekül 40,00%.



