Auteur:
Christy White
Denlaod Vun Der Kreatioun:
8 Mee 2021
Update Datum:
1 Juli 2024
Inhalt
- Ze trëppelen
- Method 1 vun 3: Een Deel: Elektroneschuelen verstoen
- Method 2 vun 3: Deel Zwee: Fannt Valence Elektronen a Metaller, Ausser Iwwergangsmetaller
- Method 3 vun 3: Drëtten Deel: Fannt Valence Elektronen an Iwwergangsmetaller
- Tipps
- Noutwendegkeete
Valence Elektronen leien an der baussenzeger Schuel vun engem Element. D'Unzuel vu Valenzelektronen an engem Atom bestëmmt d'Aart vu chemescher Bindung déi dëst Element ka bilden. De beschte Wee fir d'Zuel vu valence Elektronen erauszefannen ass d'Periodesch Tabelle vun den Elementer ze benotzen.
Ze trëppelen
Method 1 vun 3: Een Deel: Elektroneschuelen verstoen
 De Periodesch Dësch vun den Elementer. Dëst ass eng Tabell mat Faarfcoden, wou an all Zell en Element mat der atomarer Zuel an 1 bis 3 Buschtawen als Symbol ugewisen ass.
De Periodesch Dësch vun den Elementer. Dëst ass eng Tabell mat Faarfcoden, wou an all Zell en Element mat der atomarer Zuel an 1 bis 3 Buschtawen als Symbol ugewisen ass.  Fannt déi atomar Zuel vum Element. D'Atomzuel ass uewen oder niewent dem Symbol vum Element. Zum Beispill: Bor (B) huet eng atomär Zuel vu 5, dat heescht datt et 5 Protonen a 5 Elektronen huet.
Fannt déi atomar Zuel vum Element. D'Atomzuel ass uewen oder niewent dem Symbol vum Element. Zum Beispill: Bor (B) huet eng atomär Zuel vu 5, dat heescht datt et 5 Protonen a 5 Elektronen huet.  Zeechent eng einfach Duerstellung vun engem Atom a plazéiert d'Elektronen op der Ëmlafbunn ëm den Atomkär. Dës Aarbechte ginn och Muschelen oder Energieniveauen genannt. Déi maximal Unzuel vun Elektronen, déi an der selwechter Schuel kënne sinn, ass fixéiert, an d'Schuelen sinn aus der bannenzeger an der äusserer Bunn gefëllt.
Zeechent eng einfach Duerstellung vun engem Atom a plazéiert d'Elektronen op der Ëmlafbunn ëm den Atomkär. Dës Aarbechte ginn och Muschelen oder Energieniveauen genannt. Déi maximal Unzuel vun Elektronen, déi an der selwechter Schuel kënne sinn, ass fixéiert, an d'Schuelen sinn aus der bannenzeger an der äusserer Bunn gefëllt. - K Shell (bannenzeg): 2 Elektronen maximal.
- L Shell: maximal 8 Elektronen.
- M Shell: maximal 18 Elektronen.
- N Shell: 32 Elektronen maximal.
- O Shell: maximal 50 Elektronen.
- P Shell (baussen): 72 Elektronen maximal.
 Fannt d'Zuel vun Elektronen an der baussenzeger Schuel. Dëst sinn d'Valence Elektronen.
Fannt d'Zuel vun Elektronen an der baussenzeger Schuel. Dëst sinn d'Valence Elektronen. - Wann d'Walensschuel voll ass, ass d'Element stabil.
- Wann d'Walensschuel net voll ass, ass d'Element reaktiv, dat heescht datt et chemesch mam Atom vun engem aneren Element ka bannen. All Atom deelt seng Valence Elektronen an engem Versuch, d'Walensschuel voll ze maachen.
Method 2 vun 3: Deel Zwee: Fannt Valence Elektronen a Metaller, Ausser Iwwergangsmetaller
 Nummeréiert all Kolonn vum periodesche System, vun 1 bis 18. Waasserstoff (H) ass uewen an der Kolonn 1 an Helium (He) uewen an der Kolonn 18. Dëst sinn déi verschidde Gruppen vun Elementer.
Nummeréiert all Kolonn vum periodesche System, vun 1 bis 18. Waasserstoff (H) ass uewen an der Kolonn 1 an Helium (He) uewen an der Kolonn 18. Dëst sinn déi verschidde Gruppen vun Elementer.  Gitt all Zeil eng Zuel, vun 1 op 7. Dëst sinn d'Perioden vun den Elementer, a si entspriechen d'Zuel vu Muschelen oder Energieniveauen vun engem Atom.
Gitt all Zeil eng Zuel, vun 1 op 7. Dëst sinn d'Perioden vun den Elementer, a si entspriechen d'Zuel vu Muschelen oder Energieniveauen vun engem Atom. - Waasserstoff (H) an Helium (He) hunn allebéid 1 Schuel, wärend de Francium (Fr) 7 huet.
- D'Lanthaniden an d'Actiniden sinn gruppéiert an ënner der Haaptsäit opgezielt. All Lanthaniden gehéieren zur Period 6, Grupp 3 an all Actiniden gehéieren zur Period 7, Grupp 3.
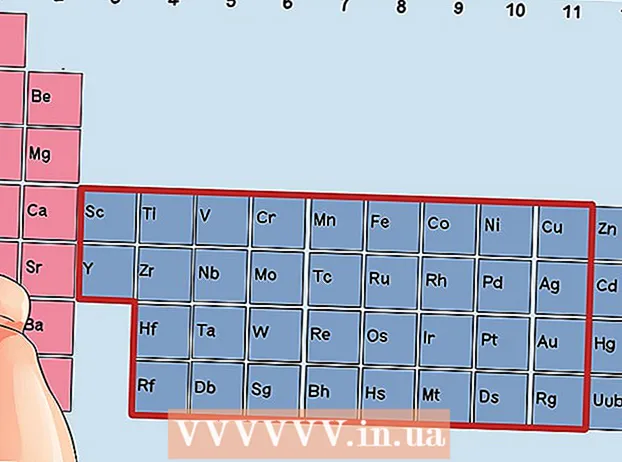
 Situéiert en Element dat net en Iwwergangsmetall ass. Iwwergangsmetaller sinn an de Gruppen 3 bis 12. D'Gruppenzuelen vun den anere Metaller weisen d'Zuel vun de Valence-Elektronen un.
Situéiert en Element dat net en Iwwergangsmetall ass. Iwwergangsmetaller sinn an de Gruppen 3 bis 12. D'Gruppenzuelen vun den anere Metaller weisen d'Zuel vun de Valence-Elektronen un. - Grupp 1: 1 Valence Elektron
- Grupp 2: 2 Valence Elektronen
- Grupp 13: 3 Valence Elektronen
- Grupp 14: 4 Valence Elektronen
- Grupp 15: 5 Valence Elektronen
- Grupp 16: 6 Valence Elektronen
- Grupp 17: 7 Valence Elektronen
- Grupp 18: 8 Valence Elektronen - ausser Helium, deen 2 huet
Method 3 vun 3: Drëtten Deel: Fannt Valence Elektronen an Iwwergangsmetaller
 Fannt en Element aus de Gruppen 3 bis 12, d'Transitiounsmetaller.
Fannt en Element aus de Gruppen 3 bis 12, d'Transitiounsmetaller. Bestëmmt d'Zuel vu valence Elektronen op Basis vun der Gruppennummer. Dës Gruppennummeren entspriechen enger méiglecher Unzuel vu Valence-Elektronen.
Bestëmmt d'Zuel vu valence Elektronen op Basis vun der Gruppennummer. Dës Gruppennummeren entspriechen enger méiglecher Unzuel vu Valence-Elektronen. - Grupp 3: 3 Valence Elektronen
- Grupp 4: 2 bis 4 Valence Elektronen
- Grupp 5: 2 bis 5 Valenzelektronen
- Grupp 6: 2 bis 6 Valence Elektronen
- Grupp 7: 2 bis 7 Valence Elektronen
- Grupp 8: 2 oder 3 Valence Elektronen
- Grupp 9: 2 oder 3 Valence Elektronen
- Grupp 10: 2 oder 3 Valence Elektronen
- Grupp 11: 1 oder 2 Valence Elektronen
- Grupp 12: 2 Valence Elektronen
Tipps
- Iwwergangsmetaller kënnen Valenzschuelen hunn, déi net ganz voll sinn. D'Bestëmmung vun der exakter Unzuel vu Valenzelektronen an Iwwergangsmetaller erfuerdert gewësse Prinzipie vun der Quantentheorie, déi iwwer de Beräich vun dësem Pabeier sinn.
Noutwendegkeete
- Periodesch Tabelle vun den Elementer
- Bläistëft
- Pabeier