Auteur:
Janice Evans
Denlaod Vun Der Kreatioun:
25 Juli 2021
Update Datum:
1 Juli 2024
Inhalt
- Schrëtt
- Deel 1 vun 2: Komponente vun der Ionescher Equatioun
- Deel 2 vun 2: Ionesch Equatioune schreiwen
- Tipps
Ionesch Equatioune sinn en integralen Deel vun der Chimie. Si enthalen nëmmen déi Komponenten déi sech am Laf vun enger chemescher Reaktioun änneren. Déi meescht dacks ginn ionesch Equatioune benotzt fir Redoxreaktiounen, Austausch an Neutraliséierungsreaktiounen ze beschreiwen.Eng ionesch Equatioun ze schreiwen erfuerdert dräi Grondstufen: Balancéieren vun der molekulärer Equatioun vun enger chemescher Reaktioun, Iwwersetzen an eng komplett ionesch Equatioun (dat heescht d'Komponente schreiwen wéi se an der Léisung existéieren), a schliisslech eng kuerz ionesch Equatioun schreiwen.
Schrëtt
Deel 1 vun 2: Komponente vun der Ionescher Equatioun
 1 Verstitt den Ënnerscheed tëscht molekulare an ionesche Verbindungen. Fir d'ionesch Equatioun ze schreiwen, den éischte Schrëtt ass d'ionesch Verbindungen ze bestëmmen déi an der Reaktioun involvéiert sinn. Ionesch Substanzen sinn déi, déi sech a geluedenen Ionen a wässerleche Léisungen dissociéieren (zersetzen). Molekulare Verbindunge briechen net an Ionen of. Si besteet aus zwee net-metallesche Elementer a ginn heiansdo als kovalent Verbindunge bezeechent.
1 Verstitt den Ënnerscheed tëscht molekulare an ionesche Verbindungen. Fir d'ionesch Equatioun ze schreiwen, den éischte Schrëtt ass d'ionesch Verbindungen ze bestëmmen déi an der Reaktioun involvéiert sinn. Ionesch Substanzen sinn déi, déi sech a geluedenen Ionen a wässerleche Léisungen dissociéieren (zersetzen). Molekulare Verbindunge briechen net an Ionen of. Si besteet aus zwee net-metallesche Elementer a ginn heiansdo als kovalent Verbindunge bezeechent. - Ionesch Verbindunge kënnen tëscht engem Metal an engem Net-Metall, engem Metal a polyatomesche Ionen optrieden, oder tëscht verschiddene polyatomesche Ionen.
- Wann Dir am Zweiwel sidd zu wéi enger Grupp eng bestëmmte Verbindung gehéiert, kuckt op d'Eegeschafte vu senge Bestanddeeler am Periodesystem.
 2 Bestëmmt d'Léisbarkeet vun der Verbindung. Net all ionesch Verbindungen opléisen sech a wässerlech Léisungen, dat heescht, net all dissozéiere sech an getrennten Ionen. Ier Dir d'Gläichung schreift, sollt Dir d'Léisbarkeet vun all Verbindung fannen. Drënner sinn kuerz Reegele fir d'Léisbarkeet. Méi Detailer an Ausnahmen zu der Regel kënnen an der Opléisungstabelle fonnt ginn.
2 Bestëmmt d'Léisbarkeet vun der Verbindung. Net all ionesch Verbindungen opléisen sech a wässerlech Léisungen, dat heescht, net all dissozéiere sech an getrennten Ionen. Ier Dir d'Gläichung schreift, sollt Dir d'Léisbarkeet vun all Verbindung fannen. Drënner sinn kuerz Reegele fir d'Léisbarkeet. Méi Detailer an Ausnahmen zu der Regel kënnen an der Opléisungstabelle fonnt ginn. - Follegt d'Regelen an der Uerdnung an där se hei ënnendrënner ginn:
- all Salze Na, K an NH4 opléisen;
- all Salze KENG3, C.2H.3O.2, ClO3 an ClO4 soluble;
- all Salze Ag, Pb an Hg2 onléislech;
- all Cl, Br an ech Salze léisen sech op;
- Salze CO3, O, S, OH, PO4, CrO4, Kr2O.7 an esou3 onléislech (mat e puer Ausnahmen);
- SO Salzer4 soluble (mat e puer Ausnahmen).
 3 Bestëmmt d'Kation an d'Anion vun der Verbindung. Positiv gelueden Ionen (normalerweis Metaller) ginn Kationen genannt. Anionen hunn eng negativ Ladung, normalerweis net-Metallionen. E puer Net-Metaller kënnen net nëmmen Anionen bilden, awer och Katioune, wärend Metallatome ëmmer als Katioune funktionnéieren.
3 Bestëmmt d'Kation an d'Anion vun der Verbindung. Positiv gelueden Ionen (normalerweis Metaller) ginn Kationen genannt. Anionen hunn eng negativ Ladung, normalerweis net-Metallionen. E puer Net-Metaller kënnen net nëmmen Anionen bilden, awer och Katioune, wärend Metallatome ëmmer als Katioune funktionnéieren. - Zum Beispill, an der Verbindung NaCl (Dësch Salz), Na ass eng positiv gelueden Kation well et e Metal ass an Cl ass en negativ gelueden Anion well et en Net-Metal ass.
 4 Bestëmmt déi polyatomesch (komplex) Ionen, déi an der Reaktioun involvéiert sinn. Esou Ionen si gelueden Molekülle, tëscht deenen hiren Atomer et sou eng staark Verbindung gëtt, datt se sech net a chemesche Reaktiounen dissociéieren. Et ass noutwendeg polyatomesch Ionen z'identifizéieren, well se hir eege Charge hunn an net an eenzel Atomer verrotten. Polyatomesch Ionen kënnen souwuel positiv wéi och negativ Ladungen hunn.
4 Bestëmmt déi polyatomesch (komplex) Ionen, déi an der Reaktioun involvéiert sinn. Esou Ionen si gelueden Molekülle, tëscht deenen hiren Atomer et sou eng staark Verbindung gëtt, datt se sech net a chemesche Reaktiounen dissociéieren. Et ass noutwendeg polyatomesch Ionen z'identifizéieren, well se hir eege Charge hunn an net an eenzel Atomer verrotten. Polyatomesch Ionen kënnen souwuel positiv wéi och negativ Ladungen hunn. - An Ärem allgemenge Chimie -Cours musst Dir e puer vun den heefegste polyatomesche Ionen memoriséieren.
- Déi heefegst polyatomesch Ionen si CO3, NEE3, NEE2, SOEN4, SOEN3, ClO4 an ClO3.
- Et gi vill aner polyatomesch Ionen, déi an engem Chemiebuch oder um Internet fonnt kënne ginn.
Deel 2 vun 2: Ionesch Equatioune schreiwen
 1 Balance déi komplett molekulär Equatioun. Ier Dir ufänkt d'ionesch Equatioun ze schreiwen, musst Dir déi originell molekulär Equatioun ausbalancéieren. Fir dëst ze maachen, ass et noutwendeg déi entspriechend Koeffizienten virun de Verbindungen ze placéieren, sou datt d'Zuel vun den Atomer vun all Element op der lénker Säit gläich ass mat hirer Zuel op der rietser Säit vun der Equatioun.
1 Balance déi komplett molekulär Equatioun. Ier Dir ufänkt d'ionesch Equatioun ze schreiwen, musst Dir déi originell molekulär Equatioun ausbalancéieren. Fir dëst ze maachen, ass et noutwendeg déi entspriechend Koeffizienten virun de Verbindungen ze placéieren, sou datt d'Zuel vun den Atomer vun all Element op der lénker Säit gläich ass mat hirer Zuel op der rietser Säit vun der Equatioun. - Schreift d'Zuel vun Atomer fir all Element op béide Säiten vun der Gleichung op.
- Füügt Koeffizienten un d'Elementer (ausser Sauerstoff a Waasserstoff) fir datt d'Zuel vun den Atomer vun all Element op der lénkser a rietser Säit vun der Equatioun d'selwecht ass.
- Balancéiert d'Wasserstoffatome.
- Balancéiert d'Sauerstoffatome.
- Zielt d'Zuel vun Atomer fir all Element op entweder Säit vun der Equatioun a gitt sécher datt et d'selwecht ass.
- Zum Beispill no der Balance vun der Cr + NiCl Equatioun2 -> CrCl3 + Ni mir kréien 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
 2 Bestëmmt den Zoustand vun all Substanz déi un der Reaktioun deelhëllt. Dëst kann dacks beurteelt ginn duerch den Zoustand vum Problem. Et gi verschidde Reegelen déi hëllefen ze bestëmmen a wéi engem Zoustand en Element oder eng Verbindung ass.
2 Bestëmmt den Zoustand vun all Substanz déi un der Reaktioun deelhëllt. Dëst kann dacks beurteelt ginn duerch den Zoustand vum Problem. Et gi verschidde Reegelen déi hëllefen ze bestëmmen a wéi engem Zoustand en Element oder eng Verbindung ass. - Wann den Zoustand vun engem bestëmmten Element net am Zoustand vum Problem uginn ass, benotzt de periodesche Dësch fir et ze bestëmmen.
- Wann d'Konditioun seet datt d'Verbindung an der Léisung ass, markéiert se (rr).
- Wann Waasser an der Equatioun abegraff ass, benotzt d'Léisbarkeetstabell fir ze bestëmmen ob d'ionesch Verbindung wäert dissociéieren. Am Fall vun héijer Opléisbarkeet, dissociéiert d'Verbindung am Waasser (rr). Wann d'Verbindung niddereg Opléisbarkeet huet, bleift se fest (tv an).
- Wann Waasser net un der Reaktioun deelhëllt, bleift d'ionesch Verbindung a fester Form (tv an).
- Wann eng Säure oder eng Basis am Problem erschéngt, gi se a Waasser opgeléist (rr).
- Als Beispill, betruecht d'Reaktioun 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. A reiner Form sinn d'Elementer Cr an Ni an der zolitter Phas. NiCl2 et CrCl3 sinn löslech ionesch Verbindungen, dat heescht, si sinn an der Léisung. Sou kann dës Equatioun wéi follegt nei geschriwwe ginn: 2Cr(tv an) + 3 NaCl2(rr) -> 2CrCl3(rr) + 3Ni(tv an).
 3 Bestëmmt wéi eng Verbindungen dissociéieren (getrennt a Kationen an Anionen) an der Léisung. Bei der Dissoziatioun zerstéiert d'Verbindung a positiv (Kation) an negativ (Anion) Komponenten. Dës Komponente ginn dann an d'ionesch Equatioun vun der chemescher Reaktioun an.
3 Bestëmmt wéi eng Verbindungen dissociéieren (getrennt a Kationen an Anionen) an der Léisung. Bei der Dissoziatioun zerstéiert d'Verbindung a positiv (Kation) an negativ (Anion) Komponenten. Dës Komponente ginn dann an d'ionesch Equatioun vun der chemescher Reaktioun an. - Feststoffer, Flëssegkeeten, Gase, molekulare Verbindungen, ionesche Verbindunge mat gerénger Opléisbarkeet, polyatomesch Ionen a schwaach Saieren dissociéieren net.
- Ganz dissociéiert héichléislech ionesch Verbindungen (benotzt d'Léisbarkeetstabell) a staark Saieren (HCl(rr), HBr(rr), SALUT(rr), H.2SO4(rr), HClO4(rr) an HNO3(rr)).
- Notéiert datt och wa polyatomesch Ionen sech net dissociéieren, se an d'ionesch Verbindung integréiert kënne ginn an dovun an enger Léisung getrennt sinn.
 4 Berechent d'Laascht vun all dissociéierten Ion. Maacht drun, datt Metaller positiv gelueden Katioune bilden, an net-Metallatome ginn an negativ Anionen. Bestëmmt d'Belaaschtunge vun den Elementer no dem periodesche Dësch. Et ass och noutwendeg fir all Käschten an neutrale Verbindungen ze balanséieren.
4 Berechent d'Laascht vun all dissociéierten Ion. Maacht drun, datt Metaller positiv gelueden Katioune bilden, an net-Metallatome ginn an negativ Anionen. Bestëmmt d'Belaaschtunge vun den Elementer no dem periodesche Dësch. Et ass och noutwendeg fir all Käschten an neutrale Verbindungen ze balanséieren. - Am uewe genannte Beispill, NiCl2 dissociéiert an Ni a Cl, a CrCl3 decomposes zu Cr an Cl.
- Den Néckelion huet eng 2+ Ladung well se un zwee Chlorionen gebonnen ass, jidderee mat enger eenzeger negativer Ladung. An dësem Fall muss een Ni -Ion zwee negativ gelueden Cl Ionen balanséieren. De Cr Ion huet eng 3+ Ladung, well se muss dräi negativ gelueden Cl Ionen neutraliséieren.
- Denkt drun datt polyatomesch Ionen hir eege Chargen hunn.
 5 Schreift d'Gleichung sou datt all löslech Verbindungen an eenzel Ionen getrennt sinn. Alles wat dissociéiert oder ioniséiert (wéi staark Säuren) brécht an zwou getrennte Ionen of. An dësem Fall bleift d'Substanz an engem opgeléiste Staat (rr). Préift ob d'Gleichung ausgeglach ass.
5 Schreift d'Gleichung sou datt all löslech Verbindungen an eenzel Ionen getrennt sinn. Alles wat dissociéiert oder ioniséiert (wéi staark Säuren) brécht an zwou getrennte Ionen of. An dësem Fall bleift d'Substanz an engem opgeléiste Staat (rr). Préift ob d'Gleichung ausgeglach ass. - Feststoffer, Flëssegkeeten, Gase, schwaach Säuren an ionesch Verbindunge mat gerénger Opléisbarkeet ännere hire Staat net a wäerten sech net an Ionen trennen. Loosst se wéi se waren.
- Molekulare Verbindunge wäerte einfach an d'Léisung streuen, an hire Staat ännert sech op opgeléist (rr). Et ginn dräi molekulare Verbindungen déi net wäert an de Staat goen (rr), dëst ass CH4(G.), C.3H.8(G.) an C.8H.18(f).
- Fir d'Reaktioun ënner Berücksichtegung kann déi komplett ionesch Equatioun an der folgender Form geschriwwe ginn: 2Cr(tv an) + 3Ni(rr) + 6Cl(rr) -> 2 Kr(rr) + 6Cl(rr) + 3Ni(tv an)... Wann Chlor net Deel vun der Verbindung ass, brécht et an eenzel Atomer of, sou datt mir d'Zuel vu Cl Ionen mat 6 op béide Säiten vun der Equatioun multiplizéiert hunn.
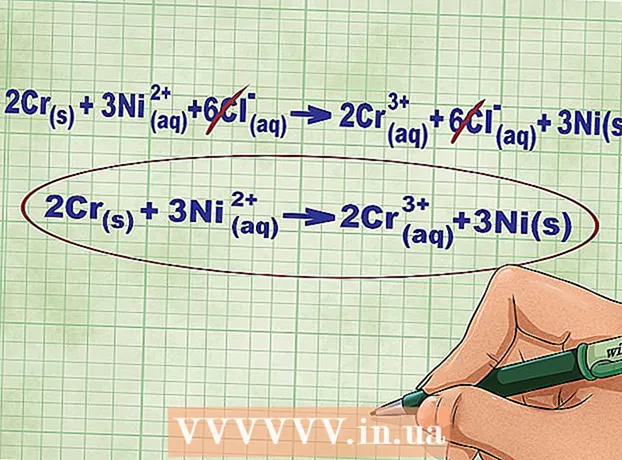
 6 Ofbriechen déi gläich Ionen op der lénkser a rietser Säit vun der Equatioun. Dir kënnt nëmmen dës Ionen duerchstrecken, déi op béide Säiten vun der Equatioun komplett identesch sinn (hunn déiselwecht Käschten, Abonnementer, asw.). Schreift d'Gleichung ouni dës Ionen.
6 Ofbriechen déi gläich Ionen op der lénkser a rietser Säit vun der Equatioun. Dir kënnt nëmmen dës Ionen duerchstrecken, déi op béide Säiten vun der Equatioun komplett identesch sinn (hunn déiselwecht Käschten, Abonnementer, asw.). Schreift d'Gleichung ouni dës Ionen. - An eisem Beispill enthalen béid Säiten vun der Gleichung 6 Cl Ionen, déi kënne duerchgestreckt ginn. Also kréien mir eng kuerz ionesch Equatioun: 2Cr(tv an) + 3Ni(rr) -> 2 Kr(rr) + 3Ni(tv an).
- Préift d'Resultat. D'Gesamtkäschte vun der lénkser a rietser Säit vun der ionescher Equatioun mussen d'selwecht sinn.
Tipps
- Trainéiert Iech selwer ëmmer schreift den Zoustand vun der Aggregatioun vun alle Komponenten an all Equatioune vu chemesche Reaktiounen op.