Auteur:
Mark Sanchez
Denlaod Vun Der Kreatioun:
3 Januar 2021
Update Datum:
1 Juli 2024
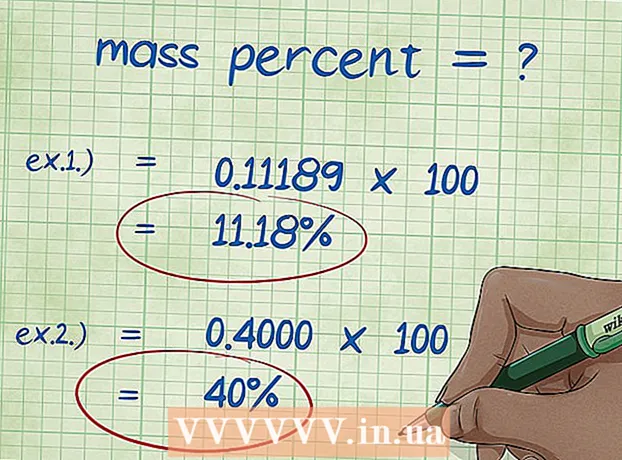
Inhalt
- Schrëtt
- Method 1 vun 2: Bestëmmung vu Masseprozent op Basis vu spezifesche Gewiichter
- Method 2 vun 2: Bestëmmung vu Masseprozent Wa keng Mass uginn ass
Massprozent spezifizéiert de Prozentsaz vun den Elementer an enger chemescher Verbindung. Fir de Masseprozent ze fannen, musst Dir d'Molermass (a Gramm pro Mol) vun den Elementer, déi an der Verbindung enthale sinn, oder d'Zuel vu Gramm vun all Komponent erfuerderen fir eng bestëmmte Léisung ze kréien.De Masseprozent gëtt ganz einfach berechent: et ass genuch fir d'Mass vum Element (oder Komponent) mat der Mass vun der ganzer Verbindung (oder Léisung) ze deelen.
Schrëtt
Method 1 vun 2: Bestëmmung vu Masseprozent op Basis vu spezifesche Gewiichter
 1 Wielt eng Equatioun fir de Gewiichtprozent vun enger chemescher Verbindung ze bestëmmen. De Masseprozent gëtt berechent mat der folgender Formel: Massprozent = (Mass vun der Komponent / Gesamtmass vun der Verbindung) x 100. Fir Prozent ze kréien, gëtt d'Resultat vun der Divisioun mat 100 multiplizéiert.
1 Wielt eng Equatioun fir de Gewiichtprozent vun enger chemescher Verbindung ze bestëmmen. De Masseprozent gëtt berechent mat der folgender Formel: Massprozent = (Mass vun der Komponent / Gesamtmass vun der Verbindung) x 100. Fir Prozent ze kréien, gëtt d'Resultat vun der Divisioun mat 100 multiplizéiert. - Am Ufank vum Problem ze léisen, schreift d'Gläichheet op: Mass Prozentsaz = (Mass vun Komponent / Gesamt Mass vun der Verbindung) x 100.
- D'Mass vun der Komponente an där Dir interesséiert sidd sollt am Zoustand vum Problem sinn. Wa keng Mass gëtt, spréngt op déi nächst Sektioun, déi erkläert wéi ee Masseprozent mat onbekannter Mass bestëmmt.
- D'Gesamtmass vun enger chemescher Verbindung gëtt fonnt andeems d'Massen vun allen Elementer (Komponenten) derbäigesat ginn, déi Deel vun dëser Verbindung (oder Léisung) sinn.
 2 Berechent d'Gesamtmass vun der Verbindung. Wann Dir d'Masse vun all de Komponente kennt, déi d'Verbindung ausmaachen, füügt se just derbäi, an op dës Manéier fannt Dir d'Gesamsmass vun der resultéierender Verbindung oder der Léisung. Dir benotzt dës Mass als Nenner an Ärer Equatioun fir Massprozent.
2 Berechent d'Gesamtmass vun der Verbindung. Wann Dir d'Masse vun all de Komponente kennt, déi d'Verbindung ausmaachen, füügt se just derbäi, an op dës Manéier fannt Dir d'Gesamsmass vun der resultéierender Verbindung oder der Léisung. Dir benotzt dës Mass als Nenner an Ärer Equatioun fir Massprozent. - Beispill 1: Wat ass de Masseprozent vun 5 Gramm Natriumhydroxid opgeléist an 100 Gramm Waasser?
- D'Gesamtmass vun der Léisung ass gläich wéi d'Zomm vun der Quantitéit vum Natriumhydroxid a Waasser: 100 g + 5 g gëtt 105 g.
- Beispill 2: Wéi vill Natriumchlorid a Waasser braucht Dir fir 175 Gramm vun enger 15 Prozent Léisung ze maachen?
- An dësem Beispill gëtt d'Gesamtsmass an den erfuerderleche Prozentsaz uginn, an et ass noutwendeg d'Quantitéit u Substanz ze fannen déi an d'Léisung bäigefüügt muss ginn. D'Gesamtgewiicht ass 175 Gramm.
- Beispill 1: Wat ass de Masseprozent vun 5 Gramm Natriumhydroxid opgeléist an 100 Gramm Waasser?
 3 Bestëmmt d'Mass vun der spezifizéierter Komponent. Wann Dir gefrot gëtt "Mass Prozent" ze berechnen, sollt Dir erausfannen wéivill Prozent vun der Gesamtmass vun enger Substanz d'Mass vun engem bestëmmte Komponent ass. Notéiert d'Mass vun der spezifizéierter Komponent. Dëst wäert den Teller an der Formel fir de Masseprozent sinn.
3 Bestëmmt d'Mass vun der spezifizéierter Komponent. Wann Dir gefrot gëtt "Mass Prozent" ze berechnen, sollt Dir erausfannen wéivill Prozent vun der Gesamtmass vun enger Substanz d'Mass vun engem bestëmmte Komponent ass. Notéiert d'Mass vun der spezifizéierter Komponent. Dëst wäert den Teller an der Formel fir de Masseprozent sinn. - Beispill 1: D'Mass vun enger bestëmmter Komponent - Natriumhydrochlorid - ass 5 Gramm.
- Beispill 2: An dësem Beispill ass d'Mass vun der gegebener Komponent onbekannt a muss fonnt ginn.
 4 Plug d'Wäerter an d'Mass Prozent Equatioun an. Nodeems Dir all déi erfuerderlech Wäerter bestëmmt hutt, plug se an d'Formel.
4 Plug d'Wäerter an d'Mass Prozent Equatioun an. Nodeems Dir all déi erfuerderlech Wäerter bestëmmt hutt, plug se an d'Formel. - Beispill 1: Massprozent = (Massekomponent / Gesamtmass vun der Verbindung) x 100 = (5 g / 105 g) x 100.
- Beispill 2: et ass noutwendeg d'Formel fir de Massprozent ze transforméieren sou datt déi onbekannt Mass vum chemesche Bestanddeel fonnt ka ginn: Mass vum Komponent = (Massprozent * Gesamtmass vun der Verbindung) / 100 = (15 * 175) / 100.
 5 Berechent de Masseprozent. Nom Ersatz vun alle Wäerter an der Formel fir de Masseprozent, féieren déi néideg Berechnungen aus. Deelt d'Mass vun enger Komponent mam Gesamtgewiicht vun der chemescher Verbindung oder der Léisung a multiplizéiert mat 100. D'Resultat ass de Masseprozent vun deem Komponent.
5 Berechent de Masseprozent. Nom Ersatz vun alle Wäerter an der Formel fir de Masseprozent, féieren déi néideg Berechnungen aus. Deelt d'Mass vun enger Komponent mam Gesamtgewiicht vun der chemescher Verbindung oder der Léisung a multiplizéiert mat 100. D'Resultat ass de Masseprozent vun deem Komponent. - Beispill 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Also ass de Gewiichtprozent vu 5 Gramm Natriumhydrochlorid opgeléist an 100 Gramm Waasser 4.761%.
- Beispill 2: De nei geschriwwenen Ausdrock fir de Masseprozent vun enger Komponent ass (Massprozent * Gesamtmass vun der Substanz) / 100, aus deem mir fannen: (15 * 175) / 100 = (2625) / 100 = 26,25 Gramm vun Natriumchlorid.
- Mir fannen déi erfuerderlech Quantitéit Waasser andeems d'Mass vum Komponent vun der Gesamtmass vun der Léisung subtrahéiert gëtt: 175 - 26,25 = 148,75 Gramm Waasser.
Method 2 vun 2: Bestëmmung vu Masseprozent Wa keng Mass uginn ass
 1 Wielt eng Formel fir de Gewiichtprozent vun enger chemescher Verbindung. D'Basisvergläichung fir Masseprozent ze fannen ass wéi follegt: Massprozent = (Molmass vun engem Element / Gesamtmolekularmass vun enger Verbindung) x 100. Molmass vun enger Substanz ass d'Mass vun engem Mol vun enger bestëmmter Substanz, wärend Molekularmass ass d'Mass vun engem Mol vun de ganze chemesche Verbindungen. D'Divisioun gëtt mat 100 multiplizéiert fir d'Prozentzuelen ze kréien.
1 Wielt eng Formel fir de Gewiichtprozent vun enger chemescher Verbindung. D'Basisvergläichung fir Masseprozent ze fannen ass wéi follegt: Massprozent = (Molmass vun engem Element / Gesamtmolekularmass vun enger Verbindung) x 100. Molmass vun enger Substanz ass d'Mass vun engem Mol vun enger bestëmmter Substanz, wärend Molekularmass ass d'Mass vun engem Mol vun de ganze chemesche Verbindungen. D'Divisioun gëtt mat 100 multiplizéiert fir d'Prozentzuelen ze kréien. - Am Ufank vum Problem ze léisen, schreift d'Gläichheet op: Mass Prozent = (Molmass vum Element / Gesamtmolekular Mass vun der Verbindung) x 100.
- Béid Quantitéite ginn a Gramm pro Mol (g / mol) gemooss.
- Wann Dir keng Mass kritt, kann de Masseprozent vun engem Element an enger bestëmmter Substanz mat Hëllef vun der Molmass fonnt ginn.
- Beispill 1: Fannt de Masseprozentzuel vu Waasserstoff an enger Waassermolekül.
- Beispill 2: Fannt de Masseprozent vu Kuelestoff an enger Glukosemolekül.
 2 Schreift d'chemesch Formel op. Wann d'Beispill keng chemesch Formelen vun de spezifizéierte Substanzen gëtt, sollt Dir se selwer opschreiwen. Wann d'Aufgab déi néideg Formelen fir chemesch Substanzen enthält, kënnt Dir dëse Schrëtt iwwersprangen an direkt op den nächste Schrëtt goen (fënnt d'Mass vun all Element).
2 Schreift d'chemesch Formel op. Wann d'Beispill keng chemesch Formelen vun de spezifizéierte Substanzen gëtt, sollt Dir se selwer opschreiwen. Wann d'Aufgab déi néideg Formelen fir chemesch Substanzen enthält, kënnt Dir dëse Schrëtt iwwersprangen an direkt op den nächste Schrëtt goen (fënnt d'Mass vun all Element). - Beispill 1: Schreift d'chemesch Formel vum Waasser, H2O.
- Beispill 2: Schreift d'chemesch Formel vu Glukos, C op6H.12O.6.
 3 Fannt d'Mass vun all Element an der Verbindung. Bestëmmt dat molescht Gewiicht vun all Element an der chemescher Formel no dem Periodesystem. Normalerweis gëtt d'Mass vun engem Element ënner sengem chemesche Symbol uginn. Schreift d'Molermassen vun all den Elementer aus, déi d'Verbindung a Fro stellen.
3 Fannt d'Mass vun all Element an der Verbindung. Bestëmmt dat molescht Gewiicht vun all Element an der chemescher Formel no dem Periodesystem. Normalerweis gëtt d'Mass vun engem Element ënner sengem chemesche Symbol uginn. Schreift d'Molermassen vun all den Elementer aus, déi d'Verbindung a Fro stellen. - Beispill 1: Fannt déi molmass Sauerstoff (15.9994) a Waasserstoff (1.0079).
- Beispill 2: Fannt déi molmasseg Kuelestoff (12.0107), Sauerstoff (15.9994) a Waasserstoff (1.0079).
 4 Multiplizéiert d'Molermass vun all Element mat senger Molfraktioun. Bestëmmt wéi vill Mol vun all Element an enger bestëmmter Chemikalie enthale sinn, dat heescht d'Molfraktiounen vun den Elementer. Molfraktiounen ginn vun den Zuelen um Enn vun den Elementsymboler an der Formel uginn. Multiplizéiert d'Molermass vun all Element mat senger Molfraktioun.
4 Multiplizéiert d'Molermass vun all Element mat senger Molfraktioun. Bestëmmt wéi vill Mol vun all Element an enger bestëmmter Chemikalie enthale sinn, dat heescht d'Molfraktiounen vun den Elementer. Molfraktiounen ginn vun den Zuelen um Enn vun den Elementsymboler an der Formel uginn. Multiplizéiert d'Molermass vun all Element mat senger Molfraktioun. - Beispill 1: et gëtt 2 ënner dem Wasserstoffsymbol, an 1 ënner dem Sauerstoffsymbol (entsprécht dem Fehlen vun enger Zuel). Sou soll d'Molermass vum Waasserstoff mat 2 multiplizéiert ginn: 1.00794 X 2 = 2.01588; mir loossen d'Molermass vum Sauerstoff d'selwecht, 15.9994 (dat heescht multiplizéieren mat 1).
- Beispill 2: ënner dem Symbol vu Kuelestoff gëtt et 6, ënner Waasserstoff 12 an ënner Sauerstoff 6. D'Molmassen vun den Elementer mat dësen Zuelen ze multiplizéieren, fanne mir:
- Kuelestoff: (12.0107 * 6) = 72.0642
- Waasserstoff: (1.00794 * 12) = 12.09528
- Sauerstoff: (15.9994 * 6) = 95.9964
 5 Berechent d'Gesamtmass vun der Verbindung. Füügt déi fonnt Massen vun all den Elementer an dëser Verbindung abegraff. D'Zomm vun de Molmassen vun den Elementer multiplizéiert mat de Molfraktiounen ginn Iech d'Gesamtsmass vun der chemescher Verbindung. Dës Zuel ass den Divisor an der Formel fir Massprozent.
5 Berechent d'Gesamtmass vun der Verbindung. Füügt déi fonnt Massen vun all den Elementer an dëser Verbindung abegraff. D'Zomm vun de Molmassen vun den Elementer multiplizéiert mat de Molfraktiounen ginn Iech d'Gesamtsmass vun der chemescher Verbindung. Dës Zuel ass den Divisor an der Formel fir Massprozent. - Beispill 1: Füügt zu 2.01588 g / mol (d'Mass vun zwee Mol Waasserstoffatome) 15.9994 g / mol (d'Mass vun engem Mol Sauerstoffatomer), d'Resultat ass 18.01528 g / mol.
- Beispill 2: Füügt déi fonnt Molmassen un: Kuelestoff + Waasserstoff + Sauerstoff = 72.0642 + 12.09528 + 95.9964 = 180.156 g / mol.
 6 Bestëmmt d'Mass vum Element vun Interesse. Wann Dir gefrot gëtt de "Masseprozent" ze fannen, da sollt Dir d'Mass vun engem bestëmmten Element berechnen, deen Deel vun der Verbindung ass, als Prozentsaz vun der Gesamtmass vun allen Elementer. Fannt d'Mass vun engem bestëmmten Element a schreift se op. Fir dëst ze maachen ass et noutwendeg d'Molermass vum Element mat senger Molfraktioun ze multiplizéieren. Als Resultat kritt Dir de Wäert am Teller vun der Formel fir de Masseprozent.
6 Bestëmmt d'Mass vum Element vun Interesse. Wann Dir gefrot gëtt de "Masseprozent" ze fannen, da sollt Dir d'Mass vun engem bestëmmten Element berechnen, deen Deel vun der Verbindung ass, als Prozentsaz vun der Gesamtmass vun allen Elementer. Fannt d'Mass vun engem bestëmmten Element a schreift se op. Fir dëst ze maachen ass et noutwendeg d'Molermass vum Element mat senger Molfraktioun ze multiplizéieren. Als Resultat kritt Dir de Wäert am Teller vun der Formel fir de Masseprozent. - Beispill 1: D'Mass vum Waasserstoff an der Verbindung ass 2.01588 g / mol (d'Mass vun zwee Mol Waasserstoffatome).
- Beispill 2: D'Mass vu Kuelestoff an der Verbindung ass 72,0642 g / mol (d'Mass vu sechs Mol Kuelestoffatomer).
 7 Ersetzen numeresch Wäerter an d'Massprozent Gleichung. Nodeems Dir d'Wäerter vun alle Quantitéite bestëmmt hutt, plugg se an d'Formel déi am éischte Schrëtt uginn ass: Massprozent = (Molmass vum Element / Gesamtmolekular Mass vun der Verbindung) x 100.
7 Ersetzen numeresch Wäerter an d'Massprozent Gleichung. Nodeems Dir d'Wäerter vun alle Quantitéite bestëmmt hutt, plugg se an d'Formel déi am éischte Schrëtt uginn ass: Massprozent = (Molmass vum Element / Gesamtmolekular Mass vun der Verbindung) x 100. - Beispill 1: Massprozent = (Molmass vum Element / Gesamtmolekular Mass vun der Verbindung) x 100 = (2.01588 / 18.01528) x 100.
- Beispill 2: Massprozent = (Molmass vum Element / Gesamtmolekularmass vun der Verbindung) x 100 = (72.0642 / 180.156) x 100.
 8 Berechent de Masseprozent. Nom Ersatz vun numeresche Wäerter, féieren déi erfuerderlech arithmetesch Operatiounen aus.Deelt d'Mass vum Element mat der Gesamtmass vun der Verbindung a multiplizéiert mat 100. D'Resultat ass de Masseprozent vum Element.
8 Berechent de Masseprozent. Nom Ersatz vun numeresche Wäerter, féieren déi erfuerderlech arithmetesch Operatiounen aus.Deelt d'Mass vum Element mat der Gesamtmass vun der Verbindung a multiplizéiert mat 100. D'Resultat ass de Masseprozent vum Element. - Beispill 1: Massprozent = (Molmass vum Element / Gesamtmolekular Mass vun der Verbindung) x 100 = (2.01588 / 18.01528) x 100 = 0.111189 x 100 = 11.18%. Also ass de Masseprozent vu Waasserstoffatome an engem Waassermolekül 11,18%.
- Beispill 2: Massprozent = (Molmass vum Element / Gesamte Molekularmass vun der Verbindung) x 100 = (72.0642 / 180.156) x 100 = 0.4000 x 100 = 40.00%. Also ass de Gewiichtprozent vu Kuelestoffatomer an der Glukosemolekül 40,00%.



