Auteur:
Virginia Floyd
Denlaod Vun Der Kreatioun:
6 August 2021
Update Datum:
1 Juli 2024
Inhalt
- Schrëtt
- Method 1 vun 3: D'Basics
- Method 2 vun 3: Bestëmmung vun der Aart vu Bindung duerch Elektronegativitéit
- Method 3 vun 3: Berechnung vu Mulliken Elektronegativitéit
- Tipps
An der Chimie ass Elektronegativitéit d'Fäegkeet vun Atomer fir Elektronen vun aneren Atomer un hinnen unzezéien. En Atom mat héijer Elektronegativitéit zitt Elektronen staark un, an en Atom mat niddereg Elektronegativitéit zitt Elektronen schwaach un. Elektronegativitéit Wäerter gi benotzt fir d'Behuele vu verschiddenen Atomer a chemesche Verbindungen virauszesoen.
Schrëtt
Method 1 vun 3: D'Basics
 1 Chemesch Obligatiounen. Esou Obligatiounen entstinn wann Elektronen an Atomer matenee interagéieren, dat heescht zwee Elektronen (een aus all Atom) ginn üblech.
1 Chemesch Obligatiounen. Esou Obligatiounen entstinn wann Elektronen an Atomer matenee interagéieren, dat heescht zwee Elektronen (een aus all Atom) ginn üblech. - Eng Beschreiwung vun de Grënn fir d'Interaktioun vun Elektronen an Atomer ass iwwer den Ëmfang vun dësem Artikel.Fir méi Informatioun iwwer dëst Thema, liest zum Beispill dësen Artikel.
 2 Effekt vun der Elektronegativitéit. Wann zwee Atomer géigesäiteg Elektronen unzezéien, ass d'Kraaft vun der Attraktioun net d'selwecht. En Atom mat enger méi héijer Elektronegativitéit zitt zwee Elektronen méi staark un. En Atom mat enger ganz héijer Elektronegativitéit lackelt Elektronen mat sou enger Kraaft un, datt mir net méi iwwer gedeelt Elektronen schwätzen.
2 Effekt vun der Elektronegativitéit. Wann zwee Atomer géigesäiteg Elektronen unzezéien, ass d'Kraaft vun der Attraktioun net d'selwecht. En Atom mat enger méi héijer Elektronegativitéit zitt zwee Elektronen méi staark un. En Atom mat enger ganz héijer Elektronegativitéit lackelt Elektronen mat sou enger Kraaft un, datt mir net méi iwwer gedeelt Elektronen schwätzen. - Zum Beispill, an der NaCl Molekül (Natriumchlorid, allgemeng Salz), huet de Chloratom eng zimlech héich Elektronegativitéit, an den Natriumatom ass zimmlech niddereg. Also Elektronen ginn un de Chloratom ugezunn an widderstoen Natriumatomer.
 3 Elektronegativitéitstabell. Dësen Dësch enthält chemesch Elementer déi op déiselwecht Manéier arrangéiert sinn wéi am Periodesystem, awer fir all Element gëtt d'Elektronegativitéit vun hiren Atomer uginn. Esou en Dësch kann a Chemie Léierbicher, Referenzmaterialien an um Internet fonnt ginn.
3 Elektronegativitéitstabell. Dësen Dësch enthält chemesch Elementer déi op déiselwecht Manéier arrangéiert sinn wéi am Periodesystem, awer fir all Element gëtt d'Elektronegativitéit vun hiren Atomer uginn. Esou en Dësch kann a Chemie Léierbicher, Referenzmaterialien an um Internet fonnt ginn. - Dir fannt en exzellente Elektronegativitéitstabell hei. Notéiert datt et d'Pauling Elektronegativitéit Skala benotzt, déi am meeschte verbreet ass. Wéi och ëmmer, et ginn aner Weeër fir d'Elektronegativitéit ze berechnen, eng vun deenen hei drënner diskutéiert ginn.
 4 Elektronegativitéit Trends. Wann Dir keen Elektronegativitéitstabelle bei der Hand hutt, kënnt Dir d'Elektronegativitéit vun engem Atom schätzen no der Lag vun engem Element am Periodesystem.
4 Elektronegativitéit Trends. Wann Dir keen Elektronegativitéitstabelle bei der Hand hutt, kënnt Dir d'Elektronegativitéit vun engem Atom schätzen no der Lag vun engem Element am Periodesystem. - Wéi no riets d'Element läit, den méi d'Elektronegativitéit vu sengem Atom.
- Wéi méi héich d'Element läit, den méi d'Elektronegativitéit vu sengem Atom.
- Also hunn d'Atomer vun den Elementer an der ieweschter rechter Eck vum Periodesystem déi héchst Elektronegativitéiten, an d'Atomer vun den Elementer am ënneschten lénksen Eck hunn déi ënnescht.
- An eisem NaCl Beispill kënne mir soen datt Chlor eng méi héich Elektronegativitéit huet wéi Natrium, well Chlor läit riets vum Natrium.
Method 2 vun 3: Bestëmmung vun der Aart vu Bindung duerch Elektronegativitéit
 1 Berechent den Ënnerscheed tëscht den Elektronegativitéite vun zwee Atomer fir d'Charakteristike vun der Verbindung tëscht hinnen ze verstoen. Fir dëst ze maachen, subtrahéiert déi méi kleng Elektronegativitéit vun der méi grousser.
1 Berechent den Ënnerscheed tëscht den Elektronegativitéite vun zwee Atomer fir d'Charakteristike vun der Verbindung tëscht hinnen ze verstoen. Fir dëst ze maachen, subtrahéiert déi méi kleng Elektronegativitéit vun der méi grousser. - Zum Beispill, betruecht den HF Molekül. Subtract the electronegativity of hydrogen (2.1) from the electronegativity of fluor (4.0): 4.0 - 2.1 = 1,9.
 2 Wann den Ënnerscheed manner wéi 0,5 ass, dann ass d'Bindung kovalent net-polär, an där Elektronen mat bal déiselwecht Kraaft ugezunn ginn. Esou Obligatiounen ginn tëscht zwee identesche Atomer geformt. Net-polare Verbindunge si meeschtens ganz schwéier ze briechen. Dëst ass well Atomer Elektronen deelen, wat hir Verbindung stabil mécht. Et brauch vill Energie fir et ze zerstéieren.
2 Wann den Ënnerscheed manner wéi 0,5 ass, dann ass d'Bindung kovalent net-polär, an där Elektronen mat bal déiselwecht Kraaft ugezunn ginn. Esou Obligatiounen ginn tëscht zwee identesche Atomer geformt. Net-polare Verbindunge si meeschtens ganz schwéier ze briechen. Dëst ass well Atomer Elektronen deelen, wat hir Verbindung stabil mécht. Et brauch vill Energie fir et ze zerstéieren. - Zum Beispill d'Molekül O2 huet dës Zort Verbindung. Well zwee Sauerstoffatome déiselwecht Elektronegativitéit hunn, ass den Ënnerscheed tëscht hinnen 0.
 3 Wann den Ënnerscheed am Beräich vun 0,5 - 1,6 läit, dann ass d'Bindung kovalent polär. An dësem Fall lackelt ee vun deenen zwee Atomer Elektronen méi staark un an kritt dofir eng deelweis negativ Ladung, an deen aneren eng deelweis positiv Ladung. Dës Ladungsonbalance erlaabt de Molekül un bestëmmte Reaktiounen deelzehuelen.
3 Wann den Ënnerscheed am Beräich vun 0,5 - 1,6 läit, dann ass d'Bindung kovalent polär. An dësem Fall lackelt ee vun deenen zwee Atomer Elektronen méi staark un an kritt dofir eng deelweis negativ Ladung, an deen aneren eng deelweis positiv Ladung. Dës Ladungsonbalance erlaabt de Molekül un bestëmmte Reaktiounen deelzehuelen. - Zum Beispill d'Molekül H2O (Waasser) huet dës Zort Verbindung. Den O Atom ass méi elektronegativ wéi zwee H Atomer, sou datt Sauerstoff Elektronen méi staark unzitt a kritt eng deelweis negativ Ladung, a Waasserstoff - eng deelweis positiv Ladung.
 4 Wann den Ënnerscheed méi grouss ass wéi 2.0, dann ass d'Bindung ionesch. Dëst ass eng Verbindung an där dat gemeinsam Elektronepaar haaptsächlech an en Atom mat enger méi héijer Elektronegativitéit passéiert, déi eng negativ Ladung kritt, an en Atom mat enger méi niddereger Elektronegativitéit eng positiv Ladung kritt. Moleküle mat sou Obligatiounen reagéiere gutt mat aneren Atomer a kënne souguer vu polare Atomer zerstéiert ginn.
4 Wann den Ënnerscheed méi grouss ass wéi 2.0, dann ass d'Bindung ionesch. Dëst ass eng Verbindung an där dat gemeinsam Elektronepaar haaptsächlech an en Atom mat enger méi héijer Elektronegativitéit passéiert, déi eng negativ Ladung kritt, an en Atom mat enger méi niddereger Elektronegativitéit eng positiv Ladung kritt. Moleküle mat sou Obligatiounen reagéiere gutt mat aneren Atomer a kënne souguer vu polare Atomer zerstéiert ginn. - Zum Beispill huet d'NaCl (Natriumchlorid) Molekül dës Zort Verbindung.De Chloratom ass sou elektronegativ datt et béid Elektronen an sech selwer lackelt an eng negativ Ladung kritt, an den Natriumatom kritt eng positiv Ladung.
- NaCl ka vun engem polare Molekül zerstéiert ginn wéi H2O (Waasser). An enger Waassermolekül ass d'Waasserstoff Säit vun der Molekül positiv an d'Sauerstoff Säit ass negativ. Wann Dir Salz mat Waasser mëscht, briechen d'Waassermoleküle d'Salzmoleküle of, wat et opléist.
 5 Wann den Ënnerscheed tëscht 1.6 an 2.0 ass, kuckt no Metall. Wann e Metallatom an enger Molekül präsent ass, dann ass d'Bindung ionesch. Wann et keng Metallatome an der Molekül sinn, dann ass d'Bindung polär kovalent.
5 Wann den Ënnerscheed tëscht 1.6 an 2.0 ass, kuckt no Metall. Wann e Metallatom an enger Molekül präsent ass, dann ass d'Bindung ionesch. Wann et keng Metallatome an der Molekül sinn, dann ass d'Bindung polär kovalent. - Metaller sinn op der lénker Säit an am Zentrum vum Periodesystem. An dëser Tabell ginn Metaller beliicht.
- An eisem HF Beispill fält den Ënnerscheed tëscht Elektronegativitéite bannent dësem Beräich. Well H a F keng Metaller sinn, ass d'Bindung polare kovalent.
Method 3 vun 3: Berechnung vu Mulliken Elektronegativitéit
 1 Fannt déi éischt Ioniséierungsenergie vun engem Atom. D'Mulliken Elektronegativitéit Skala ass liicht anescht wéi déi uewe genannte Pauling Skala. Déi éischt Ioniséierungsenergie ass noutwendeg fir een Atom aus engem Elektron ze läschen.
1 Fannt déi éischt Ioniséierungsenergie vun engem Atom. D'Mulliken Elektronegativitéit Skala ass liicht anescht wéi déi uewe genannte Pauling Skala. Déi éischt Ioniséierungsenergie ass noutwendeg fir een Atom aus engem Elektron ze läschen. - D'Bedeitung vun esou Energie kann a Chemie Referenzbicher oder um Netz fonnt ginn, zum Beispill hei.
- Als Beispill, loosst eis d'Elektronegativitéit vu Lithium (Li) fannen. Seng éischt Ioniséierungsenergie ass 520 kJ / mol.
 2 Fannt d'Energie vun der Affinitéit fir en Elektron. Dëst ass d'Energie verëffentlecht am Prozess fir en Elektron un en Atom ze befestigen. D'Bedeitung vun esou Energie kann a Chemie Referenzbicher oder um Netz fonnt ginn, zum Beispill hei.
2 Fannt d'Energie vun der Affinitéit fir en Elektron. Dëst ass d'Energie verëffentlecht am Prozess fir en Elektron un en Atom ze befestigen. D'Bedeitung vun esou Energie kann a Chemie Referenzbicher oder um Netz fonnt ginn, zum Beispill hei. - D'Elektronaffinitéit Energie vu Lithium ass 60 kJ / mol.
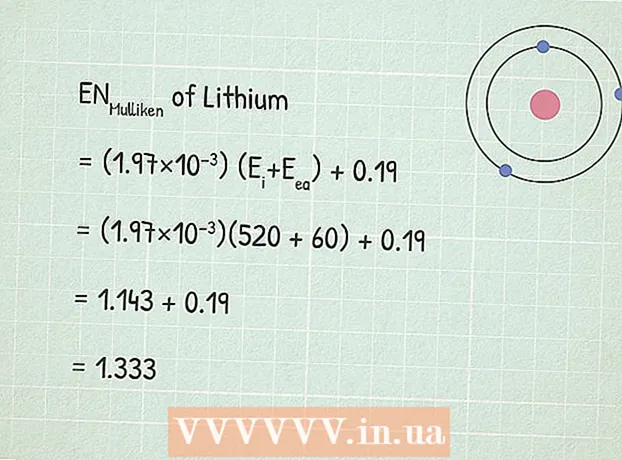
 3 Benotzt Mulliken's Elektronegativitéit Equatioun:RUMulliken = (1.97 × 10) (Eech+ E anea) + 0,19.
3 Benotzt Mulliken's Elektronegativitéit Equatioun:RUMulliken = (1.97 × 10) (Eech+ E anea) + 0,19. - An eisem Beispill:
- RUMulliken = (1.97 × 10) (Eech+ E anea) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- An eisem Beispill:
Tipps
- Zousätzlech zu de Pauling a Mulliken Skalen, ginn et Elektronegativitéit Skala laut Allred-Rochow, Sanderson, Allen. Si hunn all hir eege Formelen fir d'Elektronegativitéit ze berechnen (e puer vun hinnen si ganz komplizéiert).
- Elektronegativitéit huet keng Moosseenheeten.