Auteur:
Sara Rhodes
Denlaod Vun Der Kreatioun:
12 Februar 2021
Update Datum:
26 Juni 2024

Inhalt
- Schrëtt
- Method 1 vun 3: Wat ass de pH
- Method 2 vun 3: Berechent de pH vun enger bekannter Konzentratioun
- Method 3 vun 3: Berechent d'Konzentratioun aus engem bekannten pH
- Tipps
Am Alldag gëtt de pH normalerweis verstanen als eng Skala déi benotzt gëtt fir d'Neutralitéit ze beschreiwen oder, am Géigendeel, de Mangel un Neutralitéit vun enger Substanz. A wëssenschaftleche Begrëffer entsprécht de pH -Wäert dem Betrag vun Ionen an enger chemescher Léisung. Wann Dir Chimie oder ähnlech Themen studéiert, musst Dir eventuell den pH -Niveau berechnen op Basis vun der Konzentratioun vu Substanzen an der Léisung. De pH -Wäert gëtt mat der folgender Formel fonnt: pH = -lg [H3O] an.
Schrëtt
Method 1 vun 3: Wat ass de pH
 1 Léiert iwwer de pH. Den pH -Wäert entsprécht der Konzentratioun vu Waasserstoffionen an der Léisung. Eng Léisung mat enger verstäerkter Konzentratioun vu Waasserstoffionen gëtt sauer genannt, an eng Léisung mat enger reduzéierter Konzentratioun vun dësen Ionen gëtt alkalesch genannt. Wasserstoffionen ginn kuerz als H. bezeechent. Si kënnen och als Deel vun enger Verbindung duergestallt ginn, da ginn se Hydronium genannt a ginn als H geschriwwen30.
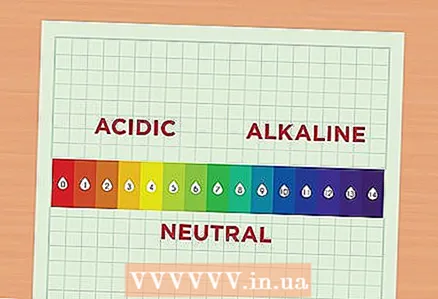
1 Léiert iwwer de pH. Den pH -Wäert entsprécht der Konzentratioun vu Waasserstoffionen an der Léisung. Eng Léisung mat enger verstäerkter Konzentratioun vu Waasserstoffionen gëtt sauer genannt, an eng Léisung mat enger reduzéierter Konzentratioun vun dësen Ionen gëtt alkalesch genannt. Wasserstoffionen ginn kuerz als H. bezeechent. Si kënnen och als Deel vun enger Verbindung duergestallt ginn, da ginn se Hydronium genannt a ginn als H geschriwwen30. - Liest d'PH Skala. D'PH Skala läit tëschent 1 an 14. Wat manner d'Zuel ass, wat méi sauer d'Léisung ass. Ëmgekéiert, wat méi héich de Wäert ass, wat méi alkalesch d'Léisung ass. Zum Beispill ass den pH vum Orangensaft 2 well dëse Jus eng zimlech sauer Flëssegkeet ass. Chlorbleich huet e pH vun 12 well et vill Alkali enthält. An der Mëtt vun der Skala si relativ neutral Léisungen, sou wéi Waasser, deen e pH vun 7 huet.
- En 1-Punkt Ënnerscheed tëscht zwou Léisungen op der pH Skala heescht datt se an der Aciditéit mat engem Faktor vun 10 ënnerscheeden. Zum Beispill, wann Dir zwou Léisunge mam pH 6 a 7 hëlt, ass d'Aciditéit vun der éischter Léisung mat pH 6 10 Mol méi héich wéi d'Aciditéit vun der zweeter Léisung mam pH 7. An zum Beispill d'Aciditéit vun enger Léisung mat engem pH 6 ass 100 Mol méi héich wéi d'Aciditéit vun enger Léisung mat engem pH vun 8.
 2 Memoréiert d'Gleichung fir de pH ze bestëmmen. D'PH Skala gëtt berechent mat dem negativen Dezimal Logarithmus. En negativen Dezimallogarithmus entsprécht der Unzuel vun den Nullen, déi virun engem stinn, inklusiv Null ganz Zuelen: zum Beispill den negativen Dezimal Logarithmus vun 0.1 ass 1, 0.01 ass 2, asw. D'Formel fir de pH ze fannen ass wéi follegt: pH = -lg [H3O] an.
2 Memoréiert d'Gleichung fir de pH ze bestëmmen. D'PH Skala gëtt berechent mat dem negativen Dezimal Logarithmus. En negativen Dezimallogarithmus entsprécht der Unzuel vun den Nullen, déi virun engem stinn, inklusiv Null ganz Zuelen: zum Beispill den negativen Dezimal Logarithmus vun 0.1 ass 1, 0.01 ass 2, asw. D'Formel fir de pH ze fannen ass wéi follegt: pH = -lg [H3O] an. - Heiansdo gëtt d'Formel als pH = -lg [H] geschriwwen. Et ass egal ob d'Gläichung H3O oder H, béid si gläichwäerteg.
- Et ass net néideg fir de Dezimallogarithmus ze berechnen fir de pH ze fannen, well bal all wëssenschaftlech oder technesch Rechner eng Optioun huet fir et ze berechnen.
 3 Léiert iwwer d'Konzentratioun. D'Konzentratioun vun enger Substanz entsprécht der Unzuel vun de Partikelen vun dëser Substanz an der Léisung. In der Regel gëtt d'Konzentratioun ausgedréckt an der Unzuel vu Mol pro Volumen Eenheet a gëtt als m / V bezeechent, oder M. A chemesche Laboratoiren gëtt d'Konzentratioun vu Léisungen op d'Flaschen mat hinne geschriwwen. Wann Dir e chemesche Problem léist, kann d'Konzentratioun an der Bedingung uginn ginn, oder et muss fonnt ginn.
3 Léiert iwwer d'Konzentratioun. D'Konzentratioun vun enger Substanz entsprécht der Unzuel vun de Partikelen vun dëser Substanz an der Léisung. In der Regel gëtt d'Konzentratioun ausgedréckt an der Unzuel vu Mol pro Volumen Eenheet a gëtt als m / V bezeechent, oder M. A chemesche Laboratoiren gëtt d'Konzentratioun vu Léisungen op d'Flaschen mat hinne geschriwwen. Wann Dir e chemesche Problem léist, kann d'Konzentratioun an der Bedingung uginn ginn, oder et muss fonnt ginn.
Method 2 vun 3: Berechent de pH vun enger bekannter Konzentratioun
 1 Denkt un d'Formel fir den pH ze fannen. Hei ass d'Formel: pH = -lg [H3O] an. Gitt sécher datt Dir all d'Elementer vertraut sidd, déi dës Formel ausmaachen. Kuckt wéi e Wäert der Konzentratioun entsprécht.
1 Denkt un d'Formel fir den pH ze fannen. Hei ass d'Formel: pH = -lg [H3O] an. Gitt sécher datt Dir all d'Elementer vertraut sidd, déi dës Formel ausmaachen. Kuckt wéi e Wäert der Konzentratioun entsprécht. - An der Chimie bedeit Quadrat Klammeren d'Konzentratioun vun eppes.Also d'Formel fir de pH ze berechnen liest "pH ass gläich wéi den negativen Logarithmus vun der Hydroniumionkonzentratioun."
 2 Bestëmmt déi tatsächlech Konzentratioun. Liest d'Problemerklärung suergfälteg. Fannt d'Konzentratioun vu Säure oder Alkali an de Quelldaten. Schreift déi komplett Formel op e Pabeier of, ersetzt déi bekannt Wäerter an. Fir Duercherneen ze vermeiden, gitt ëmmer Moosseenheeten nieft Zuelen un.
2 Bestëmmt déi tatsächlech Konzentratioun. Liest d'Problemerklärung suergfälteg. Fannt d'Konzentratioun vu Säure oder Alkali an de Quelldaten. Schreift déi komplett Formel op e Pabeier of, ersetzt déi bekannt Wäerter an. Fir Duercherneen ze vermeiden, gitt ëmmer Moosseenheeten nieft Zuelen un. - Zum Beispill, wann d'Konzentratioun 1,05 x 10 M ass, schreift d'Formel fir de pH wéi folgend ze berechnen: pH = -lg [1,05 x 10 M]
 3 Berechent de pH. Et ass bequem e wëssenschaftleche Rechner dofir ze benotzen. Gitt als éischt de Minuszeechen un andeems Dir op de "+/-" Knäppchen dréckt. Da dréckt de "Log" Knäppchen entspriechend dem Dezimal Logarithmus (op Englesch gëtt Dezimal Logarithmus als Log bezeechent). Den Écran weist "-log". Dréckt dann déi lénks Klammer a gitt d'Konzentratioun an. Vergiesst net de Gradwäert unzeginn wann néideg. Dann d'Klammeren zoumaachen. Als Resultat gesitt Dir "-log (1.05x10) um Rechnerbildschierm. Klickt "=". Dir sollt e pH -Wäert vun ongeféier 4,98 hunn.
3 Berechent de pH. Et ass bequem e wëssenschaftleche Rechner dofir ze benotzen. Gitt als éischt de Minuszeechen un andeems Dir op de "+/-" Knäppchen dréckt. Da dréckt de "Log" Knäppchen entspriechend dem Dezimal Logarithmus (op Englesch gëtt Dezimal Logarithmus als Log bezeechent). Den Écran weist "-log". Dréckt dann déi lénks Klammer a gitt d'Konzentratioun an. Vergiesst net de Gradwäert unzeginn wann néideg. Dann d'Klammeren zoumaachen. Als Resultat gesitt Dir "-log (1.05x10) um Rechnerbildschierm. Klickt "=". Dir sollt e pH -Wäert vun ongeféier 4,98 hunn.
Method 3 vun 3: Berechent d'Konzentratioun aus engem bekannten pH
 1 Bestëmmt wat kritt gëtt a wat Dir wëllt fannen. Schreift d'Formel fir de pH ze berechnen. Fannt dann déi bekannte Wäerter eraus andeems Dir hir Wäerter ënner der Formel ausschreift. Zum Beispill, wann Dir wësst datt Äre pH 10,1 ass, schreift dës Nummer ënner pH an Ärer Formel.
1 Bestëmmt wat kritt gëtt a wat Dir wëllt fannen. Schreift d'Formel fir de pH ze berechnen. Fannt dann déi bekannte Wäerter eraus andeems Dir hir Wäerter ënner der Formel ausschreift. Zum Beispill, wann Dir wësst datt Äre pH 10,1 ass, schreift dës Nummer ënner pH an Ärer Formel.  2 Konvertéiert d'Formel. An dësem Fall braucht Dir Wëssen aus dem Schoulalgebra Cours. Fir d'Konzentratioun aus engem bekannte pH -Wäert ze berechnen, ass et noutwendeg d'Formel ze transforméieren sou datt d'Konzentratioun sech vu béide Säiten vun der Gleichung ofhält. Dat ass, et ass noutwendeg datt op enger Säit vum Gläichtzeechen en Ausdrock ass deen den pH -Wäert enthält, an op där anerer - d'Konzentratioun vum Hydronium. Als éischt multiplizéieren zwou Säiten vun der Equatioun mat -1. Da erhéicht 10 op d'Kraaft op béide Säiten vun der resultéierender Gläichheet.
2 Konvertéiert d'Formel. An dësem Fall braucht Dir Wëssen aus dem Schoulalgebra Cours. Fir d'Konzentratioun aus engem bekannte pH -Wäert ze berechnen, ass et noutwendeg d'Formel ze transforméieren sou datt d'Konzentratioun sech vu béide Säiten vun der Gleichung ofhält. Dat ass, et ass noutwendeg datt op enger Säit vum Gläichtzeechen en Ausdrock ass deen den pH -Wäert enthält, an op där anerer - d'Konzentratioun vum Hydronium. Als éischt multiplizéieren zwou Säiten vun der Equatioun mat -1. Da erhéicht 10 op d'Kraaft op béide Säiten vun der resultéierender Gläichheet. - Konvertéieren der Gläichheet pH = -log [H3O], mir kréien d'Formel + [H3O] = 10, dat heescht, d'Ion Konzentratioun ass zéng zu der -pH Kraaft. Elo, amplaz vum pH, ersetzen mir e bekannte Wäert, an eisem Fall 10.1.
 3 Solvéiert d'Gleichung. Et gëtt eng spezifesch Prozedur fir zéng op eng Kraaft am Rechner ze erhéijen. Éischt Typ 10. Da dréckt d'Exponentiatiounsschlëssel. Gitt e Minuszeechen an e Gradwäert an. Klickt "=".
3 Solvéiert d'Gleichung. Et gëtt eng spezifesch Prozedur fir zéng op eng Kraaft am Rechner ze erhéijen. Éischt Typ 10. Da dréckt d'Exponentiatiounsschlëssel. Gitt e Minuszeechen an e Gradwäert an. Klickt "=". - An eisem Beispill ass de pH 10,1. Wielt "10" an dréckt op den "EXP" Schlëssel. Da dréckt "- / +", ännert d'Schëld. Endlech gitt de pH Wäert "10.1" an dréckt den "=" Schlëssel. Als Resultat sollt Dir mat 1e-100 ophalen. Dëst bedeit datt d'Konzentratioun 1,00 x 10 M.
 4 Betruecht d'Äntwert déi Dir kritt hutt. Mécht et kierperlecht Sënn? Wann de pH 10,1 ass, heescht et datt d'Konzentratioun vum Hydronium extrem niddereg ass an Dir hutt eng alkalesch Léisung. Also entsprécht déi fonnt ganz niddereg Konzentratioun
4 Betruecht d'Äntwert déi Dir kritt hutt. Mécht et kierperlecht Sënn? Wann de pH 10,1 ass, heescht et datt d'Konzentratioun vum Hydronium extrem niddereg ass an Dir hutt eng alkalesch Léisung. Also entsprécht déi fonnt ganz niddereg Konzentratioun
Tipps
- Wann d'Berechnung vun Ärem pH Niveau am Ufank schwéier ass, bedenkt datt et vill Quelle gi fir méi iwwer dëst Thema ze léieren. Benotzt e Chemie -Léierbuch oder frot en Enseignant fir Iech ze hëllefen.