Auteur:
Charles Brown
Denlaod Vun Der Kreatioun:
2 Februar 2021
Update Datum:
28 Juni 2024

Inhalt
- Ze trëppelen
- Method 1 vun 3: Basis ionesch Bindungen
- Method 2 vun 3: Iwwergangsmetaller
- Method 3 vun 3: Bänn mat polyatomesche Ionen
- Tipps
Ionbindunge bestinn aus Kationen (positive Ionen) an Anionen (negativ Ionen). Ionbindunge bestinn normalerweis aus engem Metal an engem oder méi Net-Metaller. Fir eng Ionebindung ze nennen, musst Dir just den Numm vum Kation an dem Anion an der Verbindung fannen. Dir musst als éischt den Numm vum Metal opschreiwen, gefollegt vum Numm vum Net-Metal mat deem entspriechenden neien Enn. Wann Dir wësse wëllt wéi Ionobligatiounen a verschiddene Situatiounen nennen, befollegt just dës Schrëtt.
Ze trëppelen
Method 1 vun 3: Basis ionesch Bindungen
 Schreift d'Ionebindungsformel op. Loosst eis déi ionesch Bindung soen, un där Dir schafft NaCl ass.
Schreift d'Ionebindungsformel op. Loosst eis déi ionesch Bindung soen, un där Dir schafft NaCl ass.  Schreift den Numm vum Metal, oder d'Katioun. Dëst ass de positiv geluedenen Ion an der Verbindung an et gëtt ëmmer als éischt an enger Ionebindungsformel geschriwwen. Nodeems ass Natrium. Also schreift Natrium an.
Schreift den Numm vum Metal, oder d'Katioun. Dëst ass de positiv geluedenen Ion an der Verbindung an et gëtt ëmmer als éischt an enger Ionebindungsformel geschriwwen. Nodeems ass Natrium. Also schreift Natrium an.  Schreift den Numm vum Net-Metal, oder den Anion, mam "-ide" Schluss op.Cl ass Chlor (Chlor). Fir den "ide" Schluss bäizefügen, ersetzt just déi lescht Silb "-ine" duerch "-ide". Gëtt Chlor Chlorid.
Schreift den Numm vum Net-Metal, oder den Anion, mam "-ide" Schluss op.Cl ass Chlor (Chlor). Fir den "ide" Schluss bäizefügen, ersetzt just déi lescht Silb "-ine" duerch "-ide". Gëtt Chlor Chlorid.  Kombinéiert d'Nimm. NaCl kann als geschriwwe ginn Natriumchlorid.
Kombinéiert d'Nimm. NaCl kann als geschriwwe ginn Natriumchlorid.  Praxis Benennung vun einfachen ionesche Bindungen. Wann Dir dës Formel gelongen ass, probéiert e puer méi einfach ionesch Bindungen ze nennen. Och e puer memoriséieren kann hëllefen Iech e bessert Verständnis ze ginn wéi Dir Ionobligatiounen nennt. Hei sinn e puer méi:
Praxis Benennung vun einfachen ionesche Bindungen. Wann Dir dës Formel gelongen ass, probéiert e puer méi einfach ionesch Bindungen ze nennen. Och e puer memoriséieren kann hëllefen Iech e bessert Verständnis ze ginn wéi Dir Ionobligatiounen nennt. Hei sinn e puer méi: - Li2S = Lithiumsulfid

- Ag2S = Sëlwer Sulfid

- MgCl2 = Magnesiumchlorid

- Li2S = Lithiumsulfid
Method 2 vun 3: Iwwergangsmetaller
 Schreift d'Ionebindungsformel op. Iwwergangsmetaller kënnen am Zentrum vum periodesche System fonnt ginn. Si hunn hiren Numm kritt well hir Oxidatiounszuelen, oder hir Chargen, sech permanent veränneren. Loosst eis soen datt Dir mat dësem Bond schafft: Fe2O3.
Schreift d'Ionebindungsformel op. Iwwergangsmetaller kënnen am Zentrum vum periodesche System fonnt ginn. Si hunn hiren Numm kritt well hir Oxidatiounszuelen, oder hir Chargen, sech permanent veränneren. Loosst eis soen datt Dir mat dësem Bond schafft: Fe2O3.  Schreift d'Ladung vum Metal op. Dir wësst datt d'Metall eng positiv Charge wäert hunn, sou datt Dir d'3 vun kritt O3 duerchstrecken an dat opschreiwen Fe huet eng Charge vun +3. (Dir kënnt, fir Spaass, de Reverse maachen an dat opschreiwen O huet eng Charge vun -2.) Heiansdo gëtt de Charge uginn.
Schreift d'Ladung vum Metal op. Dir wësst datt d'Metall eng positiv Charge wäert hunn, sou datt Dir d'3 vun kritt O3 duerchstrecken an dat opschreiwen Fe huet eng Charge vun +3. (Dir kënnt, fir Spaass, de Reverse maachen an dat opschreiwen O huet eng Charge vun -2.) Heiansdo gëtt de Charge uginn.  Schreift den Numm vum Metal op. Zënter datt Dir dat wësst Fe Eisen an datt et eng Charge vu +3 huet, kënnt Dir et maachen Eisen (III) ze ernimmen. Denkt drun nëmme Roman Zuelen ze benotzen wann Dir den Numm schreift an net wann Dir d'Formel schreift.
Schreift den Numm vum Metal op. Zënter datt Dir dat wësst Fe Eisen an datt et eng Charge vu +3 huet, kënnt Dir et maachen Eisen (III) ze ernimmen. Denkt drun nëmme Roman Zuelen ze benotzen wann Dir den Numm schreift an net wann Dir d'Formel schreift.  Schreift den Numm vum Net-Metal op. Zënter datt Dir dat wësst O steet fir Sauerstoff, Dir kënnt de "-ide" Schluss bäifügen an "Oxid" nennen.
Schreift den Numm vum Net-Metal op. Zënter datt Dir dat wësst O steet fir Sauerstoff, Dir kënnt de "-ide" Schluss bäifügen an "Oxid" nennen.  Fusionéieren den éischten an zweeten Numm. Elo hutt Dir et. Fe2O3 = Eisen (III) Oxid.
Fusionéieren den éischten an zweeten Numm. Elo hutt Dir et. Fe2O3 = Eisen (III) Oxid.  Benotzt déi al Benennungsmethod. An der aler Benennungsmethod, déi och benotzt gëtt, benotzt Dir d'Nimm "Ferro" a "Ferri" fir d'Metaller, amplaz vun de réimeschen Zuelen. Wann de Metallion e méi nidderegen Oxidatiounszoustand huet (eng manner numeresch Charge, ignoréiert de "+" oder "-"), benotzt "Ferro". Wann et eng méi héich Charge huet benotzt Dir "ferri". Fe huet den ënneschten Zoustand (Fe huet den héije Staat), sou datt et gëtt Eisen. Den Numm vu FeO kann och als geschriwwe ginn Ferroxid.
Benotzt déi al Benennungsmethod. An der aler Benennungsmethod, déi och benotzt gëtt, benotzt Dir d'Nimm "Ferro" a "Ferri" fir d'Metaller, amplaz vun de réimeschen Zuelen. Wann de Metallion e méi nidderegen Oxidatiounszoustand huet (eng manner numeresch Charge, ignoréiert de "+" oder "-"), benotzt "Ferro". Wann et eng méi héich Charge huet benotzt Dir "ferri". Fe huet den ënneschten Zoustand (Fe huet den héije Staat), sou datt et gëtt Eisen. Den Numm vu FeO kann och als geschriwwe ginn Ferroxid. 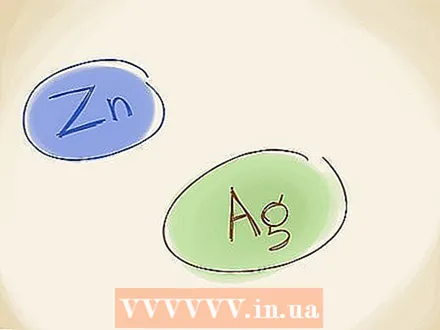 Erënnert un d'Ausnamen. Et ginn zwee Iwwergangsmetaller déi keng fix Charge hunn. Dës sinn Zénk (Zn) a Sëlwer (Ag). Dëst bedeit datt Dir net déi réimesch Zuelen oder déi al Benennungsmethod benotze musst wann Dir dës Elementer beschreift.
Erënnert un d'Ausnamen. Et ginn zwee Iwwergangsmetaller déi keng fix Charge hunn. Dës sinn Zénk (Zn) a Sëlwer (Ag). Dëst bedeit datt Dir net déi réimesch Zuelen oder déi al Benennungsmethod benotze musst wann Dir dës Elementer beschreift.
Method 3 vun 3: Bänn mat polyatomesche Ionen
 Schreift d'polyatomesch Ionformel op. Dës Verbindung wäert aus méi wéi zwee Ionen bestoen. Loosst eis soen datt Dir un der folgender Bindung schafft: FeNH4(SO4)2.
Schreift d'polyatomesch Ionformel op. Dës Verbindung wäert aus méi wéi zwee Ionen bestoen. Loosst eis soen datt Dir un der folgender Bindung schafft: FeNH4(SO4)2.  Fannt d'Ladung vum Metal. Dir musst eng Mathematik maache fir se ze fannen. Als éischt wësst Dir datt et Sulfat ass, oder SO4 Ion, huet eng Charge vun -2 an datt et der zwee sinn, wéinst der 2 ënner der Klammer. Also, 2x -2 = -4. Da wësst Dir datt NH4, oder den Ammoniakion, huet eng Charge vu +1. Füügt -4 an 1 derbäi an Dir kritt -3. Dëst bedeit datt den Eisenion, Fe, eng Charge vun +3 muss hunn fir en auszegläichen an d'Bindung neutral ze maachen.
Fannt d'Ladung vum Metal. Dir musst eng Mathematik maache fir se ze fannen. Als éischt wësst Dir datt et Sulfat ass, oder SO4 Ion, huet eng Charge vun -2 an datt et der zwee sinn, wéinst der 2 ënner der Klammer. Also, 2x -2 = -4. Da wësst Dir datt NH4, oder den Ammoniakion, huet eng Charge vu +1. Füügt -4 an 1 derbäi an Dir kritt -3. Dëst bedeit datt den Eisenion, Fe, eng Charge vun +3 muss hunn fir en auszegläichen an d'Bindung neutral ze maachen.  Schreift den Numm vum Metal op. An dësem Fall kënnt Dir béid maachen Eisen (III) wéi ferri opschreiwen.
Schreift den Numm vum Metal op. An dësem Fall kënnt Dir béid maachen Eisen (III) wéi ferri opschreiwen.  Schreift den Numm vun den net-Metal Ionen op. An dësem Fall benotzt Dir Ammonium an Sulfat, oder Ammoniumsulfat.
Schreift den Numm vun den net-Metal Ionen op. An dësem Fall benotzt Dir Ammonium an Sulfat, oder Ammoniumsulfat.  Kombinéiert den Numm vum Metal mat den Nimm vun den Net-Metaller. Dir kënnt d'Bindung FeNH nennen4(SO4)2 ginn duerch oder Eisen (III) Ammoniumsulfat oder ferrik Ammoniumsulfat schreiwen.
Kombinéiert den Numm vum Metal mat den Nimm vun den Net-Metaller. Dir kënnt d'Bindung FeNH nennen4(SO4)2 ginn duerch oder Eisen (III) Ammoniumsulfat oder ferrik Ammoniumsulfat schreiwen.
Tipps
- Wann Dir an déi entgéintgesate Richtung gitt an Dir hutt réimesch Zuelen, musst Dir e "Röntgen" vun der Molekül maachen. Déi réimesch Ziffer ass d'Belaaschtung vun der Katioun.