Auteur:
Helen Garcia
Denlaod Vun Der Kreatioun:
17 Abrëll 2021
Update Datum:
1 Juli 2024
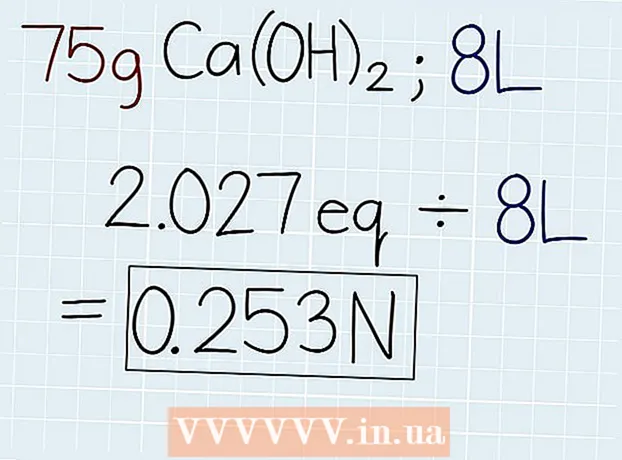
Inhalt
- Schrëtt
- Method 1 vun 2: Berechnung vun der Normalitéit iwwer Molaritéit
- Method 2 vun 2: Berechnung vun der Normalitéit an der gläichwäerteger Mass
- Tipps
- Wat brauchs du
Normalitéit weist d'Konzentratioun vu Säure oder Alkali an enger Léisung un. Fir d'Normalitéit vun enger Léisung erauszefannen, kënne béid Molaritéit an déi gläichwäerteg Mass vun der Molekül an de Berechnunge benotzt ginn. Wann Dir wielt Molaritéit ze benotzen, benotzt d'Formel N = M (n), wou M Molaritéit ass an n d'Zuel vu Waasserstoff- oder Hydroxidmoleküle ass. Wann Dir décidéiert d'Äquivalent Mass ze benotzen, benotzt d'Formel N = eq ÷ V, wou eq d'Zuel vun Äquivalenten ass a V de Volume vun der Léisung ass.
Schrëtt
Method 1 vun 2: Berechnung vun der Normalitéit iwwer Molaritéit
 1 Fügt d'Molermass vun alle Komponente vun der Léisung op. Fannt d'Elementer vun der chemescher Formel op der periodescher Tabell fir hir Atommass erauszefannen, wat mat der Molmass entsprécht. Schreift d'Molermass vun all Element op a multiplizéiert se mat der Unzuel vun deenen Elementer. Fügt d'Molermass vun alle Komponenten derbäi fir d'Gesamtzuelmolermass ze fannen.
1 Fügt d'Molermass vun alle Komponente vun der Léisung op. Fannt d'Elementer vun der chemescher Formel op der periodescher Tabell fir hir Atommass erauszefannen, wat mat der Molmass entsprécht. Schreift d'Molermass vun all Element op a multiplizéiert se mat der Unzuel vun deenen Elementer. Fügt d'Molermass vun alle Komponenten derbäi fir d'Gesamtzuelmolermass ze fannen. - Zum Beispill, wann Dir d'Molermass vu Schwefelsäure (H2SO4), fënnt d'Molermass vu Waasserstoff (1 g), Schwefel (3 g) a Sauerstoff (16 g) eraus.
- Multiplizéiert d'Mass mat der Unzuel vun de Komponenten an der Kompositioun. An eisem Beispill ginn et 2 Waasserstoffatome a 4 Sauerstoffatome. Déi total molmass vu Waasserstoff ass 2 x 1 g = 2 g. D'molare Mass vum Sauerstoff an dëser Léisung wäert 4 x 16 g = 64 g sinn.
- Fügt all Molmassen zesummen. Dir kritt 2 g + 32 g + 64 g = 98 g / mol.
- Wann Dir schonn d'Molaritéit vun der Léisung wësst, déi Dir sicht, gitt direkt op de Schrëtt 4.
 2 Deelt déi tatsächlech Mass vun der Léisung mat der Molmass. Fannt dat tatsächlech Gewiicht vun der Léisung eraus. Et gëtt entweder um Container mat der Léisung uginn, oder an der Aufgab selwer.Deelt dann d'Mass vun der Léisung mat der totaler molarer Mass, déi fréier fonnt gouf. D'Resultat ass d'Zuel vun de Mol an der Léisung, duerno soll "Mol" geschriwwe ginn.
2 Deelt déi tatsächlech Mass vun der Léisung mat der Molmass. Fannt dat tatsächlech Gewiicht vun der Léisung eraus. Et gëtt entweder um Container mat der Léisung uginn, oder an der Aufgab selwer.Deelt dann d'Mass vun der Léisung mat der totaler molarer Mass, déi fréier fonnt gouf. D'Resultat ass d'Zuel vun de Mol an der Léisung, duerno soll "Mol" geschriwwe ginn. - Zum Beispill, wann Dir probéiert d'Normalitéit vun 100 g H erauszefannen2SO4opgeléist an 12 Liter Flëssegkeet, benotzt déi tatsächlech Mass a deelt mat Molare. Als Resultat kritt Dir: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 Mol ass gläich wéi 6,02 x 10 Atomer oder Moleküle vun enger Léisung.
 3 Deelt d'Resultat mam Volume vun der Léisung a Liter fir d'Molaritéit erauszefannen. Huelt d'Zuel vun de Mol an der Léisung just berechent a deelt se mam Gesamtvolumen vun der Léisung ze moossen. Als Resultat wësst Dir d'Molaritéit (M), mat där Dir d'Konzentratioun vun der Léisung erausfanne kënnt.
3 Deelt d'Resultat mam Volume vun der Léisung a Liter fir d'Molaritéit erauszefannen. Huelt d'Zuel vun de Mol an der Léisung just berechent a deelt se mam Gesamtvolumen vun der Léisung ze moossen. Als Resultat wësst Dir d'Molaritéit (M), mat där Dir d'Konzentratioun vun der Léisung erausfanne kënnt. - Baséierend op eisem Beispill kréien mir déi folgend Formel: 1,02 mol ÷ 12 L = 0,085 M.
Rotschléi: gitt sécher de Volume vun der Léisung op Liter ëmzewandelen, wann Dir dat net scho gemaach hutt. Soss kritt Dir déi falsch Äntwert.
 4 Multiplikéiert Molaritéit mat der Unzuel vu Waasserstoff- oder Hydroxidmoleküle. Kuckt d'chemesch Formel fir d'Zuel vu Waasserstoffatome (H) an enger Säure oder Hydroxidmolekülen an (OH) an der Basis erauszefannen. Dann multiplizéiert d'Molaritéit vun der Léisung mat der Unzuel vu Waasserstoff oder Hydroxidmoleküle an där Léisung fir déi normal Konzentratioun, oder Normalitéit ze fannen. Um Enn vun Ärer Äntwert schreift d'Ofkierzung "N".
4 Multiplikéiert Molaritéit mat der Unzuel vu Waasserstoff- oder Hydroxidmoleküle. Kuckt d'chemesch Formel fir d'Zuel vu Waasserstoffatome (H) an enger Säure oder Hydroxidmolekülen an (OH) an der Basis erauszefannen. Dann multiplizéiert d'Molaritéit vun der Léisung mat der Unzuel vu Waasserstoff oder Hydroxidmoleküle an där Léisung fir déi normal Konzentratioun, oder Normalitéit ze fannen. Um Enn vun Ärer Äntwert schreift d'Ofkierzung "N". - An eisem Beispill, Schwefelsäure (H2SO4) 2 Waasserstoffatome. Also d'Formel wäert esou sinn: 0,085 M x 2 = 0,17 N.
- An engem anere Beispill huet Natriumhydroxid (NaOH) mat enger Molaritéit vun 2 M nëmmen 1 Hydroxidmolekül. Dofir wäert d'Formel wéi follegt sinn: 2 M x 1 = 2 N.
Method 2 vun 2: Berechnung vun der Normalitéit an der gläichwäerteger Mass
 1 Fannt déi total Molmass vun der Léisung eraus. Kuckt d'chemesch Formel vun der Léisung a fënnt all Element um periodeschen Dësch. Schreift d'Molermass vun all Element op a multiplizéiert se mat der Unzuel vun deenen Elementer an der Formel. Fügt all Molmassen zesummen fir d'Gesamtmolarmass a Gramm ze fannen.
1 Fannt déi total Molmass vun der Léisung eraus. Kuckt d'chemesch Formel vun der Léisung a fënnt all Element um periodeschen Dësch. Schreift d'Molermass vun all Element op a multiplizéiert se mat der Unzuel vun deenen Elementer an der Formel. Fügt all Molmassen zesummen fir d'Gesamtmolarmass a Gramm ze fannen. - Zum Beispill, wann Dir d'Molermass vu Ca (OH) wësse wëllt2, fënnt dann déi molmass vu Kalzium (40 g), Sauerstoff (16 g) a Waasserstoff (1 g) eraus.
- An der Formel ginn et 2 Atomer vu Sauerstoff a Waasserstoff. D'total Mass Sauerstoff wäert sinn: 2 x 16 g = 32 g. D'molare Mass vum Waasserstoff wäert sinn: 2 x 1 g = 2 g.
- Fügt all Molmassen zesummen fir 40 g + 32 g + 2 g = 74 g / mol ze kréien.
 2 Deelt déi molmass mat der Unzuel vu Waasserstoff- oder Hydroxidmoleküle. Fannt d'Zuel vu Waasserstoffatomer (H) an enger Säure oder Hydroxid (OH) Molekülen an der Basis eraus. Deelt déi total Molmass just kritt duerch d'Zuel vun Atomer oder Molekülle fir d'Gewiicht vun 1 Äquivalent ze fannen, wat gläich ass mat der Mass vun 1 Mol Waasserstoff oder Hydroxid. Um Enn vun der Äntwert schreift d'Ofkierzung "G.-e." heescht d'Mass vum Äquivalent.
2 Deelt déi molmass mat der Unzuel vu Waasserstoff- oder Hydroxidmoleküle. Fannt d'Zuel vu Waasserstoffatomer (H) an enger Säure oder Hydroxid (OH) Molekülen an der Basis eraus. Deelt déi total Molmass just kritt duerch d'Zuel vun Atomer oder Molekülle fir d'Gewiicht vun 1 Äquivalent ze fannen, wat gläich ass mat der Mass vun 1 Mol Waasserstoff oder Hydroxid. Um Enn vun der Äntwert schreift d'Ofkierzung "G.-e." heescht d'Mass vum Äquivalent. - An eisem Beispill, Ca (OH)2 2 zwee Wasserstoffmoleküle, dat heescht datt d'Mass vum Äquivalent gläich ass wéi 74 g / mol ÷ 2 = 37 G.-e.
 3 Deelt dat tatsächlech Gewiicht vun der Léisung mam gläichwäertegem Gewiicht. Nodeems Dir d'Mass vum Äquivalent wësst, deelt se mat der Mass vun der Léisung, déi um Container mat der Léisung oder am Problem geléist gëtt. D'Äntwert ass d'Zuel vun Äquivalenten an der Léisung sou datt Dir dann d'Normalitéit kënnt berechnen. Um Enn vun der Äntwert setzt d'Ofkierzung "e."
3 Deelt dat tatsächlech Gewiicht vun der Léisung mam gläichwäertegem Gewiicht. Nodeems Dir d'Mass vum Äquivalent wësst, deelt se mat der Mass vun der Léisung, déi um Container mat der Léisung oder am Problem geléist gëtt. D'Äntwert ass d'Zuel vun Äquivalenten an der Léisung sou datt Dir dann d'Normalitéit kënnt berechnen. Um Enn vun der Äntwert setzt d'Ofkierzung "e." - Wann an eisem Beispill 75 g Ca (OH)2, da wäert d'Formel wéi follegt sinn: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Deelt d'Zuel vun Äquivalente mam Volume vun der Léisung a Liter. Fannt de Gesamtvolumen vun der Léisung eraus a schreift d'Äntwert a Liter op. Huelt d'Zuel vun de gläichquivalenten Equivalenten a deelt mam Volume vun der Léisung fir d'Normalitéit erauszefannen. Um Enn vun Ärer Äntwert setzt eng Ofkierzung "N".
4 Deelt d'Zuel vun Äquivalente mam Volume vun der Léisung a Liter. Fannt de Gesamtvolumen vun der Léisung eraus a schreift d'Äntwert a Liter op. Huelt d'Zuel vun de gläichquivalenten Equivalenten a deelt mam Volume vun der Léisung fir d'Normalitéit erauszefannen. Um Enn vun Ärer Äntwert setzt eng Ofkierzung "N". - Wann et 75 g Ca (OH) an enger Léisung mat engem Volume vun 8 Liter ass2, deelt dann d'Zuel vun Äquivalente mam Volume op déi folgend Manéier: 2.027 Oe. ÷ 8 l = 0,253 N.
Tipps
- Normal Konzentratioun, oder Normalitéit, gëtt allgemeng benotzt fir Saieren a Basen ze moossen. Wann Dir d'Konzentratioun vun enger anerer Léisung muss bestëmmen, gëtt dëst normalerweis gemaach andeems d'Molaritéit gemooss gëtt.
Wat brauchs du
- Periodesch Dësch
- Rechner